- Cu(N3)2
-
Strukturformel 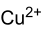

Allgemeines Name Kupfer(II)-azid Andere Namen Kupferazid
Summenformel Cu(N3)2 CAS-Nummer 14215-30-6 Kurzbeschreibung explosionsgefährlicher Feststoff Eigenschaften Molare Masse 147,59 g·mol−1 Aggregatzustand fest
Dichte 2,604 g·cm−3[1]
Schmelzpunkt explodiert bei 215 °C[1]
Löslichkeit - praktisch unlöslich in Wasser: 0,8 mg·l−1 (20 °C)[1]
- löslich in Essigsäure und verdünnte Mineralsäuren
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kupferazid ist das Kupfersalz der Stickstoffwasserstoffsäure. Es ist explosionsgefährlich und findet wegen der hohen Empfindlichkeit gegenüber Reibung und Druck keine Anwendung.[3]
Inhaltsverzeichnis
Verwendung
Kupferazid gehört zu den Initialsprengstoffen. Die grüne Modifikation ist die empfindlichste. Sie explodiert oft bereits bei Berührung. Unter dem 2-kg-Fallhammer explodiert sie bei einer Fallhöhe von unter 1 cm. Die schwarze/braune Modifikation bei 1 cm und die gelbe mit einem 1-kg-Fallhammer von 7 bis 8 cm. Bemerkenswert ist die hohe Initierfähigkeit für Nitropenta, wobei nur 0,4 mg Kupferazid ausreichen, um das Nitropenta zur Detonation zu bringen. Kupferazid hat große Bedeutung für die Praxis, da es neben Kupfer(I)-azid bei längerer Einwirkung von Bleiazid auf Kupfer oder dessen Legierungen entstehen kann.
Modifikationen
Gemäß Urbanski sind vier Modifikationen bekannt: Die wasserfreie Verbindung ist braun mit rötlichem Schein. Die grüne Modifikation entsteht bei Einwirkung von Stickstoffwasserstoffsäure auf Kupferhydroxid oder auf Kupferoxid. Manchmal hat es eine eher graue Farbe. Erwärmung in Wasser führt zur Hydrolyse unter Entstehung basischen Kupferazids von gelber Farbe.
Stoffdaten
- Detonationsgeschwindigkeit: 5000–5500 m/s
- Verpuffungspunkt: 202–205 °C
- Verbrennungswärme: 67,23 kcal/g
- Schlagempfindlichkeit: 2,66 [kpm/cm2]
- Aktivierungsenergie: 26,5 kcal/mol
Herstellung
Braune/schwarze Modifikation
Diese Form entstand durch das Einwirken von Lithiumazid auf Kupfer(II)-nitrat in alkoholischer Lösung. Nach der Methode von Curtius entsteht diese Verbindung durch Einwirkung von Stickstoffwasserstoffsäure auf metallisches Kupfer in wässrigem Medium. Dies ist die wasserfreie Verbindung.
Grüne Modifikation
Es bildet sich durch Einwirkung von Stickstoffwasserstoffsäure auf Kupferhydroxid oder (Straumanis und Cirulis) auf Kupfer(II)-oxid. Manchmal hat es eine mehr graue Farbe.
Gelbe Modifikation
Erwärmung in Wasser (Wöhler und Krupko, 1913) führt zur Hydrolyse unter Entstehung basischen Kupferazids. Sehr lange Erwärmung verursacht nach Straumanis und Cirulis die vollkommene Hydrolyse, wobei Kupferoxid und freie Säuren frei werden.
Komplexsalze
Die Komplexsalze des Kupferazids sind ebenfalls explosiv. So ist das Salz Cu(NH3)4 (N3)2 bedeutend weniger schlagempfindlich (1 kg aus einer Höhe von 20 cm). Ausnahmsweise starke Initiiereigenschaften hat das komplexe Kupfer-Lithiumhexaazid Li4(Cu(N3)6).
Warnung
Kupferazid ist kaum zu handhaben. Von der Herstellung ist dringendst abzuraten, da es durch wesentlich sicherere Initialsprengstoffe ersetzbar ist. Es bietet keinerlei Vorzüge.
Quellen
- T. Urbanski: Chemie und Technologie der Explosivstoffen Band 3
- ↑ a b c Handbook of Inorganic Compounds
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Schiess- und Sprengstoffe, von Ph. Naoum, Phokion P. Naoúm, Theodor Steinkopff, 1927, als Google-Book
Wikimedia Foundation.

