- Dielektrische Eigenschaften von Wasser und Eis
-
Dieser Artikel beschäftigt sich speziell mit den dielektrischen Eigenschaften von Wasser und Eis. Weitere Eigenschaften zu Wasser und Eis sowie zu anderen Dielektrika finden sich in den entsprechenden Hauptartikeln.
Inhaltsverzeichnis
Dielektrische Eigenschaften von Wasser
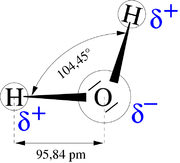
Wasser ist ein Dipol-Molekül. Der Dipol entsteht durch die polarisierte Atombindung von zwei Wasserstoffatomen H und einem Sauerstoffatom O. Durch die negative Ladung des Sauerstoffatoms und die positive Ladung der zwei Wasserstoffatome ist der Aufbau des Wassermoleküls unsymmetrisch.
Wassermoleküle können frei oder einfach gebunden auftreten. Die relative Permittivität des Wassers ändert sich sprunghaft, wenn sich der Aggregatzustand des Wassers ändert.
Steigt die Beweglichkeit des Wassermoleküls, erhöht sich auch die relative Permittivitätszahl.
Relative Permittivität einiger Stoffe
bei 18 °C und einer Frequenz von 50 Hz, sofern nicht anders angegebenMedium εr Medium εr Vakuum 1,0 Luft 1,00059 Trockene Erde 3,9 Feuchte Erde 29 Glas 6…8 Porzellan 2…6 Methanol 32,6 Wasser 80,1 Wasser (f = 2,54 GHz) 77 Wasser (sichtbarer Bereich) 1,77 Eis (−20 °C) ≈ 100 Eis (−20 °C, f > 100 kHz) 3,2 Dielektrische Eigenschaften von Wasser-Feststoff-Gemischen
Man bezeichnet Wasser-Feststoff-Gemische auch als heterogene Mischungen.Wenn Wasser chemisch oder physikalisch an einen Feststoff gebunden ist, bleiben seine Permittivitätseigenschaften in Wasser-Feststoff-Gemischen nicht erhalten. Verschiedene Polarisationseffekte können in solchen Gemischen zusammen auftreten. Je nach Eigenschaften des Stoffes können diese Effekte zur Gesamtpolarisations des Stoffes und zu einer Änderung der relativen Permittivität führen. Der jeweilige Aufbau des Wassermoleküls ist entscheidend für die Polarisation und Relaxation der elektromagnetischen Wellen bei der Bestimmung der Materialfeuchte. Für die Messgenauigkeit ist aufgrund der Polarisation die Wahl der Messfrequenz entscheidend.
Polarisationseffekte
Als dielektrische Polarisation bezeichnet man die Wechselwirkung zwischen einem elektrischen Feld und Molekülen oder Ionen eines Stoffes. Wasser weist wie alle polaren Stoffe unterschiedliche Polarisationseffekte im spektralen Bereich auf, die zu einer Erhöhung der relativen Permittivität führen. Zur Kompensation eines angelegten, elektrischen Feldes werden die Molekülladungen polarisiert. Alle Polarisationseffekte weisen spezifische Resonanz- und Relaxationsfrequenzen auf. Zu den Polarisationseffekten gehören:
Alle Polarisationseffekte nehmen mit zunehmender Frequenz ab.
Dielektrische Eigenschaften von Eis
Im Eis umgeben vier Wasserstoffatome jeweils ein Sauerstoffatom tetraederförmig. So entsteht ein mit zahlreichen Hohlräumen durchzogenes weitläufiges Gitter mit sechseckigem Querschnitt. Aufgrund dieser Hohlraumstruktur ist die Dichte von Eis geringer als die von flüssigem Wasser. Wenn Eis schmilzt, bricht die Hohlraumstruktur zusammen und die Dichte steigt an. Dies geschieht bis zu einer Temperatur von 4 °C und wird als Anomalie des Wassers bezeichnet. Wasser und Eis weisen unterschiedliche Relaxationsfrequenzen auf, die sich für verschiedene Messtechniken wie der Schneefeuchtebestimmung und der Erkennung von Tragflächenvereisung bei Flugzeugen nutzen lassen.
Literatur
- Klaus Kupfer: Materialfeuchtemessung: Grundlagen, Messverfahren, Applikationen, Normen. Expert Verlag, 1997,ISBN 3-816-91359-8.
- Christof Hübner: Hochfrequente Materialfeuchtemessverfahren. In: Forschungsbericht 2007. Hochschule Mannheim, 2007, S. 79 (PDF).
Wikimedia Foundation.