- Diels-Alder-Reaktion
-
Die Diels-Alder-Reaktion ist eine chemische Reaktion, bei der Bindungen zwischen Kohlenstoff-Atomen aufgebaut werden. Sie wurde nach ihren Entdeckern Otto Diels und Kurt Alder benannt, die für ihre Arbeit 1950 mit dem Nobelpreis ausgezeichnet wurden.[1][2][3] Bei dieser Umsetzung wird ein Ring aus sechs Kohlenstoffatomen gebildet, wobei ein konjugiertes Dien und ein substituiertes Alken verknüpft werden. Das substituierte Alken wird auch Dienophil genannt; um eine akzeptable Ausbeute zu erreichen, müssen Dien und Dienophil besondere elektronische Eigenschaften aufweisen.[4][5][6][7] Die besondere Bedeutung der Diels-Alder-Reaktion liegt darin, dass C-C-Bindungen mit hoher Stereoselektivität aufgebaut werden können. Diels-Alder-Reaktionen spielen insbesondere bei der Synthese von Naturstoffen (u. a. Aufbau von Steroiden wie z. B. dem weiblichen Sexualhormon Östradiol) eine große Rolle. Die Atomökonomie der Diels-Alder-Reaktion ist durchgängig hervorragend.
Inhaltsverzeichnis
Allgemeines
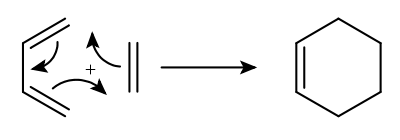
Bei der Diels-Alder-Reaktion handelt es sich um eine [4+2]-Cycloaddition. Dies bedeutet, dass 4 bzw. 2 π-Elektronen der beiden Moleküle an der Reaktion beteiligt sind. Ein typisches Beispiel ist die Reaktion von Maleinsäuredimethylester mit 1,3-Hexadien.
Die in diesem Zusammenhang oft als Beispiel gezeigte Reaktion von 1,3-Butadien mit Ethen unter Bildung von Cyclohexen kann nur als schematisch verstanden werden, ohne einen Substituenten am Dienophil reagiert das Dien mit sich selbst.
Es kommt dabei zu einer konzertierten Umlagerung von drei π-Elektronenpaaren, die zwei neue σ-Bindungen zwischen einem Dienophil und einem Dien sowie eine Doppelbindung im entstandenen Diels-Alder-Produkt bilden. Die Reaktion kann sowohl thermisch als auch photochemisch initiiert werden.
Die Stereochemie der Reaktion kann dabei durch die Anwendung der Woodward-Hoffmann-Regeln verstanden werden.
Einige Diels-Alder Reaktionen sind reversibel; die Dekomposition des cyclischen Systems in die Ausgangskomponenten nennt man Retro-Diels-Alder-Reaktion. Ein Beispiel ist der thermische Zerfall des dimeren Cyclopentadiens in Gegenwart eines Eisen-Katalysators.
Eine bei massenspektrometrischen Untersuchungen auftretende Zerfallsreaktion wird ebenfalls als "Retro-Diels-Alder" bezeichnet. Der Mechanismus ist dort jedoch nicht vergleichbar.
Mechanismus
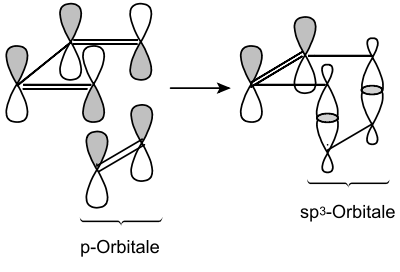
Schematisch verläuft eine Diels-Alder-Reaktion nach folgendem Mechanismus:
Dabei überlagern sich im Übergangszustand die p-Orbitale von Dien und Dienophil so, dass es zur Ausbildung von neuen chemischen Bindungen kommt. Die Pfeile sind hier lediglich schematisch aufzufassen und stellen keine Wechselwirkungen zwischen elektrophilen und nucleophilen Zentren dar.
Kinetische Betrachtung
Die Reaktionsgeschwindigkeit kann durch die Einführung von funktionalen Gruppen am Dien und/oder Dienophil (Kombination eines elektronenarmen Diens und elektronenreichen Dienophils (inverser Elektronenbedarf) bzw. eines elektronenreichen Diens und elektronenarmen Dienophils (normaler Elektronenbedarf)) erheblich erhöht werden. Die stereochemische Anordnung dieser funktionalen Gruppen im Produkt (cis oder trans) ist abhängig von der Art der Reaktion (thermisch oder photolytisch; conrotatorischer oder disrotatorischer Ringschluss) sowie der Elektronendichte der Reaktanden. Vorhersagen sind auf Basis der energetischen Lage der jeweiligen HOMO/LUMO-Orbitale (MO-Theorie) möglich.
Stereochemie und endo-Regel
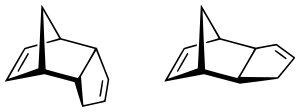
Es ist grundsätzlich die Bildung eines exo- und eines endo-Produktes denkbar. Die thermodynamisch (da sterisch) günstigere Variante ist das exo-Produkt, bei dem das Dienophil vom Dien 'weggeklappt' ist. Für den Übergangszustand der Anlagerung des Diens an das Dienophil wurde bis vor kurzem angenommen, dass der endo-Übergangszustand aufgrund sekundärer Orbitalwechselwirkungen bevorzugt wird. Berechnungen zeigen jedoch, dass dies nur 0.3 % der Stabilisierungsenergie ausmacht[8], was nicht ausreicht, um den Effekt vollständig zu erklären. Eine abschließende Erklärung steht noch aus. Durch eine kinetische Kontrolle der Reaktion (z. B. durch tiefe Temperatur, welche die reversible Reaktion unterdrückt oder verlangsamt) wird die bevorzugte Bildung des endo-Produkts gefördert, meist jedoch nicht vollständig, aber doch weit überwiegend.
Chemie der Diene
Die Dien-Komponente in der Diels-Alder-Reaktion kann sowohl offenkettig als auch cyclisch vorliegen und viele verschiedene Substituenten haben.[9] Die einzige Einschränkung ist, dass das offenkettige Dien für die Reaktion in der cis-Konfiguration vorliegen muss.[10] Diese wird aber durch ein Gleichgewicht zwischen dem cis- und trans-Isomer erreicht. Unter normalen Bedingungen liegt vorwiegend die trans-Modifikation vor; da die cis-Form dem Gleichgewicht aber entzogen wird, verschiebt es sich entsprechend dem Prinzip von Le Chatelier. Cyclische Diene liegen normalerweise immer in der cis-Konfiguration vor, weil das Umklappen nach trans durch den Ring nicht mehr möglich ist. Sie sind außergewöhnlich reaktiv. Ein Beispiel hierfür ist etwa Cyclopentadien; es reagiert trotz fehlender elektronenziehender oder elektronenschiebender Substituenten auch mit sich selbst zum Dicyclopentadien.
Chemie der Dienophile
In einer typischen Diels-Alder-Reaktion besitzt das Dienophil eine elektronenziehende Gruppe in Konjugation zur Doppelbindung. Dienophile können durch Lewis-Säuren aktiviert werden.[11]
Cyclopentadien reagiert zum Beispiel nicht mit Cyclohexenon in Ethylacetat, wenn keine Lewis-Säure die Reaktion aktiviert. α,β-ungesättigte Carbonylverbindungen können die Lewis-Säure deaktivieren.
Werden als Dienophil Aldehyde, Ketone, Imine, Thioketone oder andere Verbindungen mit Hetero-Atomen eingesetzt, spricht man auch von Hetero-Diels-Alder-Reaktionen.
Literatur
- Francesco Fringuelli, Aldo Taticchi: Dienes in the Diels-Alder Reaction. Wiley, New York 1990, ISBN 0-471-85549-9
- Nguyên Trong Anh: Die Woodward-Hoffmann-Regeln und ihre Anwendung. Verlag Chemie, Weinheim 1972, ISBN 3-527-25430-7
Einzelnachweise
- ↑ Diels, O.; Alder, K.: Synthesen in der hydroaromatischen Reihe. In: Liebigs Annalen der Chemie. 460, Nr. 1, 1928, S. 98–122. doi:10.1002/jlac.19284600106.
- ↑ Synthesis of the hydro aromatic sequence, Ann. 1929, 470, 62.
- ↑ Synthesis in the hydroaromatic series, IV. Announcement: The rearrangement of malein acid anhydride on arylated diene, triene and fulvene, Diels, O.; Alder, K. Ber. 1929, 62, 2081 & 2087.
- ↑ Kloetzel, M. C. Org. React. 1948, 4, 1–59.
- ↑ Holmes, H. L. Org. React. 1948, 4, 60–173.
- ↑ Catalytic asymmetric Diels Alder reactions, Kagan, H. B.; Riant, O. Chem. Rev. 1992, 92, 1007–1019. (Review) doi:10.1021/cr00013a013
- ↑ The Diels-Alder Reaction in Total Synthesis K. C. Nicolaou, S. A. Snyder, T. Montagnon, G. Vassilikogiannakis Angew. Chem. Int. Ed. 2002, 41, 1668–1698. doi:10.1002/1521-3773(20020517)41:10<1668::AID-ANIE1668>3.0.CO;2-Z
- ↑ Vorlesungsskript der Uni Göttingen
- ↑ Kozmin, S. A.; He, S.; Rawal, V. H. Organic Syntheses, Coll. Vol. 10, p.442 (2004); Vol. 78, p.160 (2002). (Artikel)
- ↑ Hershberg, E. B.; Ruhoff, J. R. Organic Syntheses, Coll. Vol. 2, p.102 (1943); Vol. 17, p.25 (1937). (Artikel)
- ↑ Niobium Pentachloride Activation of Enone Derivatives: Diels-Alder and Conjugate Addition Products Mauricio Gomes Constantino, Valdemar Lacerda Júnior and Gil Valdo José da Silva Molecules 2002, 7, 456–465. (Artikel)
Weblinks
- Ausführliche Rezension auf Deutsch
- Rezension auf Englisch
- Rezension auf Englisch mit vielen Beispielen und Literaturzitaten
- Die Klopman-Salem-Gleichung und die FMO-Theorie, Professor Dr. Dr. h.c. Lutz F. Tietze, Universität Göttingen. (PDF-Datei; 87 kB)
 Commons: Diels-Alder-Reaktion – Sammlung von Bildern, Videos und Audiodateien
Commons: Diels-Alder-Reaktion – Sammlung von Bildern, Videos und Audiodateien
Wikimedia Foundation.