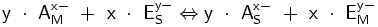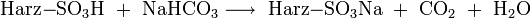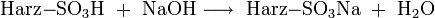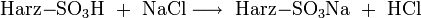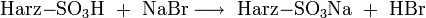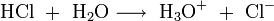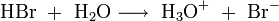- High Performance Ion Chromatography
-
Die Ionenaustauschchromatographie ist eine analytische Methode in der Chemie oder Biologie. Mit Hilfe dieses chromatografischen Verfahren können Stoffe getrennt werden. An einer polymeren Matrix befinden sich geladene funktionelle Gruppen, die reversibel Gegenionen (Kationen beim Kationenaustauscher und v.v.) gebunden haben.
Inhaltsverzeichnis
Kurzer historischer Abriss
Der Ionenaustausch gehört zu den ältesten in der Literatur beschriebenen Trennprozessen. Als der Vorgänger der Ionenaustauschchromatographie gilt die klassische Säulenchromatographie, bei der die Probe in einzelne Bestandteile mehr oder weniger aufgespalten und mit Hilfe eines automatischen Fraktionssammlers aufgefangen wird. Nun wurden die aufgefangenen Proben oftmals nasschemisch untersucht. Das Eluensvolumen betrug oft mehrere Liter. Die enorme Steigerung der Leistungsfähigkeit ist auf Small zurückzuführen. Er entwickelte reproduzierbare Ionenaustauscherharze mit niedriger Kapazität und hoher chromatographischer Effizienz. Dies führte zu einer Verminderung der Injektionsvolumina auf zehn bis 100 Mikroliter, wodurch die Auflösung gesteigert werden konnte, man erhält sehr schmale Signale. Wichtige Verbesserungen stellen die automatische Detektion, die nun kontinuierliche Aufzeichnung der Signale ermöglicht, und die Einführung der Leitfähigkeits-Detektion dar.
Das ionenchromatografische System
Mit der Pumpe wird die mobile Phase durch das gesamte System gefördert. Der Einlass der zu analysierenden Probe erfolgt mit Hilfe eines Schleifeninjektors. Die Probe wird zuerst injiziert und dann mit der Öffnung des Ventils durch die mobile Phase zum Trennsystem befördert. Injektionsvolumina von fünf bis 100 Mikroliter sind typisch. Der wichtigste Bestandteil des ionenchromatographischen Systems ist die analytische Trennsäule. Die Säulen sind aus Materialien wie beispielsweise Tefzec, Epoxidharzen oder PEEK (Polyetheretherketon) und werden in der Regel bei Raumtemperatur betrieben. Der Detektor dient zum Nachweis und zur Quantifizierung. Am häufigsten wird der Leitfähigkeitsdetektor eingesetzt, daneben werden noch UV/VIS-, amperometrische und Fluoreszenz-Detektoren verwendet. Die Aufgabe des zur Detektionseinheit gehörenden Suppressorsystems liegt in der chemischen Verringerung der Grundleitfähigkeit des als Eluenten fungierenden Elektrolyten und der Erhöhung der Leitfähigkeit der zu analysierenden Probe. Die Detektoren besitzen heutzutage oft eine serielle Schnittstelle, so dass sie mit einem PC verbunden werden können.
Die mobile Phase und der Eluent
Als mobile Phase werden alle flüssigen oder gelösten Substanzen, die als Stoffgemisch durch das ionenchromatographische System mit Hilfe der Pumpe gelangen, bezeichnet. Die mobile Phase besteht in der Regel aus Analysensubstanz (die zu analysierenden Ionen sind in der Abbildung mit „A“ gekennzeichnet) und dem Eluenten (die Eluentionen sind mit „E“ gekennzeichnet). Die Aufgabe des Eluenten ist es, die nachzuweisenden Ionen, nachdem sie an der stationären Phase ausgetauscht und gebunden wurden, wieder loszulösen, damit ein Nachweis dieser Ionen ermöglicht wird. Für diese Gleichgewichtsreaktion kann folgende allgemeine Formel angegeben werden:
Hierbei steht „A“ für das Analytion, „E“ für das Eluention, „S“ für stationäre Phase, „M“ für mobile Phase, „x“ für den Betrag der Ladung des Analtyions und „y“ für den Betrag der Ladung des Eluentions.
Die Art der einsetzbaren Elutionsmittel hängt von der verwendeten Detektionsart ab. Die Elutionsmittel für die Leitfähigkeitsdetektion werden wie folgt untergliedert:
- Elutionsmittel für die Leitfähigkeitsdetektion mit chemischer Unterdrückung der Grundleitfähigkeit und
- Elutionsmittel für die Leitfähigkeitsdetektion mit elektronischer Kompensation der Grundleitfähigkeit.
Des Weiteren müssen die Affinitäten von Eluent- und Solut- (nachzuweisenden) Ionen zur stationären Phase in etwa gleich sein.
Die stationäre Phase und die Trennsäule
Als die stationäre Phase bezeichnet man die ruhende Phase, die in der Trennsäule als Trägermaterial dient. In der HPIC verwendet man vor allem Ionenaustauscher auf Polymerbasis, da diese im Gegensatz zu den Säulen auf Kieselgelbasis auch im alkalischen Bereich stabil sind und arbeiten. Säulen, die mit Trägermaterial auf Kieselgelbasis arbeiten, besitzen eine etwas höhere chromatographische Effizienz; sie arbeiten jedoch nur im pH-Bereich von zwei bis acht. Die stationären Phasen können in der Anionenaustauschchromatographie nicht nur durch die Art ihres Grundgerüsts unterschieden werden, sondern auch durch die Porenweite und die Kapazität des Trägermaterials. Die Ionenaustausch-Kapazität ist definiert als die Zahl der Ionenaustauschergruppen pro Gewichtseinheit des Säulenfüllmaterials. Die Einheit ist Milliäquivalent pro Gramm Harz. Je höher die Austauschkapazität ist, desto länger ist die Retentionszeit für das nachzuweisende Ion. Durch Zugabe von zusätzlichem Elutionsmittel kann dieser Effekt teilweise wieder kompensiert werden.
Als Beispiel sollen hier Latex-Anionenaustauscher aufgeführt werden, welche folgende Vorteile besitzen: Das Substrat ist gegenüber mechanischen Einflüssen relativ resistent und es garantiert einen moderaten Rückdruck. Die Latexteilchen weisen eine geringe Größe auf, woraus eine hohe chromatographische Effizienz der Trennsäule resultiert. Eine solche Trennsäule unterliegt nur geringen Schwell- und Schrumpfprozessen auf Grund der Pellikularität (Oberflächenfunktionalisierung). Es können billige Elutionsmittel verwendet werden (beispielsweise Natriumhydroxidlösung). Die Säulen lassen sich für viele Trennprobleme anwenden. Die Selektivität wird von den Faktoren Höhe des Vernetzungsgrades des Latexpolymers und Art der funktionellen Gruppe am Latexpolymer beeinflusst. Die Ionenaustauschkapazität hängt von folgenden Faktoren ab:
- Partikelgröße des Substrats (antiproportional)
- Größe des Latexteilchens (proportional)
- Latexbedeckungsgrad an der Substratoberfläche (proportional).
Der Suppressor
Suppressoren werden angewandt, wenn die Detektion mittels Leitfähigkeitsmessung erfolgt. Ihre Aufgabe ist es, die Grundleitfähigkeit des Eluenten zu vermindern, deshalb erfolgt die Suppression, bevor die mobile Phase in die Leitfähigkeitsmesszelle eintritt. Ein Suppressor besteht im einfachsten Fall aus einer Ionenaustauschsäule in Wasserstoffform, das heißt die Austauschionen sind H+ bzw. H3O+.
Historisch gesehen wurden zunächst sog. Säulen-Suppressoren eingesetzt, die periodisch mit H+ zu beladen (regenerieren) waren. Vor 25 Jahren wurde dieses Verfahren von kontinuierlich arbeitenden Supppressoren (Membran-Suppressoren) abgelöst.
Folgende Gleichungen sollen diesen Austauschprozess verdeutlichen:
- der Eluent ist Natriumhydrogencarbonat (NaHCO3):
- der Eluent ist Natronlauge (NaOH):
Die nachzuweisenden Substanzen werden in analoger Weise in ihre korrespondierenden Säuren überführt:
- Analysensubstanz ist Natriumchlorid (NaCl):
- Analysensubstanz ist Natriumbromid (NaBr):
Aus diesen Gleichungen folgt, dass nur die schwach dissoziierende Kohlensäure bzw. Wasser als Reaktionsprodukt der Suppressorreaktion der Eluenten in die Leitfähigkeitsmesszelle gelangen. Diese Produkte sind fast nicht elektrisch leitend. Die Reaktionsprodukte der Analysensubstanzen sind im Gegensatz dazu sehr gut leitend, da sie im Wasser weitgehend dissoziieren:
Detektor
Die Detektionsarten werden in elektrochemische und spektroskopische Verfahren unterschieden. Zu den elektrochemischen Verfahren gehören Leitfähigkeitsdetektion und die amperometrische Detektion. Die Wahl der Detektionsart hängt von dem Trennverfahren und dem dazu benötigten Elutionsmittel ab; die Leitfähigkeitsdetektion nimmt dabei eine zentrale Stellung ein, da sie universell eingesetzt werden kann. Die elektrische Leitfähigkeit wird in Siemens pro Zentimeter angegeben und besitzt folgende Formel:
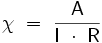 (l = Länge des Leiters, A = Querschnitt des Leiters, R = Widerstand)
(l = Länge des Leiters, A = Querschnitt des Leiters, R = Widerstand)
Die Leitfähigkeit ist proportional zur Konzentration der Ionen, zur Ladungszahl der Ionen und zur Beweglichkeit der Ionen, damit ist eine quantitative Analyse möglich. Des Weiteren steigt die Leitfähigkeit bei Temperaturerhöhung, da die Temperatur jedoch konstant gehalten wird, ist dieser Fakt zu vernachlässigen. Von dem Detektor wird das Signal an den Computer zur Datenverarbeitung gesendet.
Auswertung mit Computer
Zuerst wird eine Messung mit einer Standardlösung durchgeführt. In dieser Lösung ist eine bekannte Menge an nachzuweisenden Ionen, das heißt es wird eine bestimmte Konzentration eingestellt. Nun wird die Probe in den Schleifeninjektor gegeben und die Schleife geöffnet, anschließend werden kontinuierlich die Leitfähigkeitsmesswerte in regelmäßigen, sehr kleinen Zeitabschnitten auf den Computer übertragen. Die Leitfähigkeit, in einem Diagramm gegen die Zeit abgetragen, ergibt dann die sog. „Peaks“ in Form einer Gaußkurve. Jetzt werden die Flächen dieser Peaks, die durch das Verlängern der Grundleitfähigkeitslinie entstehen, ins Verhältnis zu der Konzentration, die ja bekannt ist, gesetzt. Wenn eine unbekannte Probe zu analysieren ist, kann man aus der Fläche der Peaks genau die Konzentration des nachzuweisenden Ions feststellen. Die Flächen werden in der Regel vom PC bestimmt und damit auch die Konzentrationen. Sollte eine Analyse von mehreren Ionen in einer Lösung notwendig sein, wie beispielsweise bei Lebensmittelanalysen, so ist hier die Identifikation der Ionen durch die charakteristischen Retentionszeiten möglich. Es muss für die quantitative Bestimmung jedoch gewährleistet sein, dass sich die Peaks der einzelnen Ionen nicht überlagern, da sonst keine eindeutigen Flächen errechnet werden können. Diese Überlagerung muss durch die Wahl eines anderen Elutionsmittels oder mit Hilfe weiterer Veränderungen, wie beispielsweise die Verwendung einer anderen Säule, beseitigt werden.
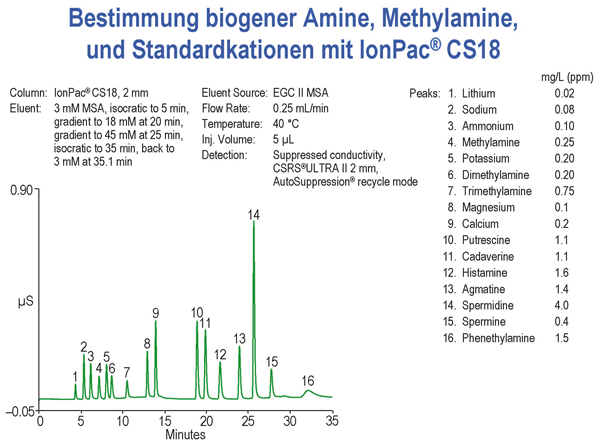
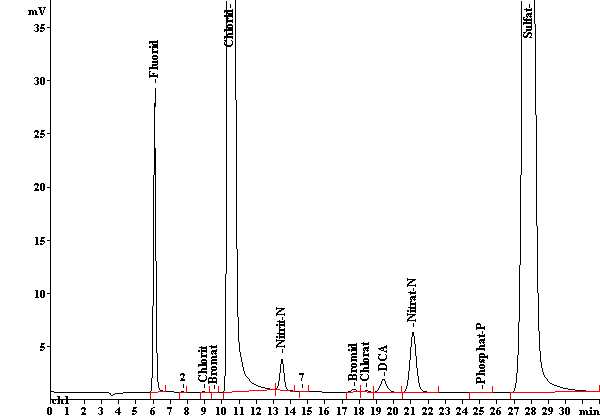
Beispielanalyse
Diese Messung wurde mit der Säule IonPac CS18 von Dionex (Sunnyvale, USA) vorgenommen. Als Eluent diente Methansulfonsäure.
Anionen in Trinkwasser (Houston, USA). Addition von Chlorit, Bromat und Chlorat, als Eluent diente Na2CO3. Die Messung wurde mit der Säule Metrosep A Supp 7 - 250 von Metrohm gemacht.
Literatur
- Hamish Small: Ion Chromatography. ISBN 0-306-43290-0
- Joachim Weiss: Handbook of Ion Chromatography, Dionex Corporation, ISBN 978-3527287017
- Joachim Weiss: Ionenchromatographie, ISBN 978-3527286980
- H. Schäfer, M. Läubli, R. Dörig: Ionenchromatographie. BestNr. 8.014.5001 (kostenlos)
- A. Seubert et. al.: Probenvorbereitungstechniken für die Ionenchromatographie. BestNr. 8.025.5001 (kostenlos)
- G. Bogenschütz, W. Frenzel, et. al.: Fortgeschrittene Detektionstechniken in der Ionenchromatographie. BestNr. 8.037.5001 (kostenlos)
- C. Eith, M. Kolb, A. Seubert, K. Viehweger: Praktikum der Ionenchromatographie. BestNr. 8.792.5011 (kostenlos)
- James S. Fritz and Douglas T. Gjerde: Ion Chromatography. ISBN 3527299149
- P.R. Haddad and P.E. Jackson: Ion Chromatography (Journal of Chromatography Library). ISBN 0444882324
Weblinks
- Ionenchromatographie Forschungszentrum Jülich vom 16. Januar 2008
- Ionenaustauschchromatographie auf Chemgapedia
Siehe auch
Wikimedia Foundation.