- Imatinibmesilat
-
Strukturformel 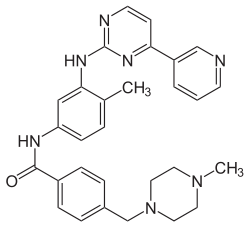
Allgemeines Freiname Imatinib Andere Namen 4-[(4-Methylpiperazin-1-yl)methyl]- N-[4-methyl-3-[(4-pyridin- 3-ylpyrimidin-2-yl)amino] phenyl]benzamid
Summenformel C29H31N7O CAS-Nummer 152459-95-5 PubChem 5291 ATC-Code L01XE01
DrugBank APRD01028 Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Fertigpräparate - Glivec® (Europa/Australien)
- Gleevec® (USA)
Eigenschaften Molare Masse 493,60 g·mol−1 Sicherheitshinweise Gefahrstoffkennzeichnung
unbekanntR- und S-Sätze R: ? S: ? Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Imatinib ist ein Arzneistoff zur Behandlung der chronischen myeloischen Leukämie (CML), von gastrointestinalen Stromatumoren (GIST) sowie weiteren malignen Erkrankungen. Es wird von der Firma Novartis unter dem Handelsnamen Glivec® (Europa/Australien) oder Gleevec® (USA) vertrieben. In der Entwicklungsphase war der Name des Wirkstoffs CGP57148B bzw. STI-571.
Erste Beobachtungen scheinen auch Therapieerfolge bei der pulmonalen Hypertonie zu bestätigen.
Inhaltsverzeichnis
Wirkmechanismus
Bei über 90 % der Patienten mit einer chronischen myeloischen Leukämie (CML) findet sich das sogenannte Philadelphia-Chromosom. Es handelt sich dabei um ein verkürztes Chromosom 22, welches durch Austausch von genetischem Material zwischen Chromosom 9 und 22 entsteht. Diesen Vorgang nennt man Translokation. Dadurch wird ein natürliches Enzym, die Tyrosinkinase ABL von Chromosom 9, mit einem Fragment des BCR-Gens auf Chromosom 22 verschmolzen. Die so mutierten Zellen produzieren ein sogenanntes Fusionsprotein BCR-ABL, eine im Vergleich zum ABL mit verstärkter Aktivität ausgestattete Tyrosinkinase, die zur unkontrollierten Vermehrung von weißen Blutkörperchen führt und eine entscheidende Rolle bei der Entstehung einer CML spielt.
Imatinib ist ein spezifischer Hemmstoff, der die Aktivität der Tyrosinkinase ABL in den erkrankten Zellen blockiert und damit die krankhaft gesteigerte Vermehrung der mutierten Blutstammzellen unterdrückt.
Ziel der Behandlung der chronischen myeloischen Leukämie mit Imatinib ist es, eine möglichst weitgehende Reduktion des pathologischen Zellklons zu erreichen. Eine molekulare Remission, bei der BCR-ABL-Transkripte auch mittels sensitiver Verfahren (RT-PCR) nicht mehr nachweisbar sind, erreicht nur eine kleinere Gruppe von Patienten. Etwa 40 % erreichen eine deutliche Reduktion von BCR-ABL in der quantitativen PCR (> 3 log-Stufen), bei mindestens 70 % sind keine Metaphasen mit dem Philadelphia-Chromosom mehr nachweisbar (komplette zytogenetische Reduktion). Eine Normalisierung des Blutbildes (komplette hämatologische Remission) wird unter Imatinib bei über 95 % der Patienten erreicht.
Molekularer Wirkmechanismus
Der Wirkmechanismus von Imatinib besteht in der kompetitiven und selektiven Blockade der ATP-Bindungsstelle spezifischer Tyrosinkinasen, wie z. B. Abl, Bcr-Abl, c-Kit und der PDGF-Rezeptor. Durch diese Blockade wird die Übertragung eines Phosphatrestes auf das Substrat verhindert. Imatinib wirkt auch auf das physiologisch vorkommende Abl. Gesunde Zellen besitzen jedoch zusätzliche Signalwege und werden kaum in ihrer Funktion gestört. Krebszellen hingegen sind abhängig von der Aktivität von Bcr-Abl und werden in ihrer Teilungs- und Überlebensfähigkeit stark beeinträchtigt.
Metabolismus
Bioverfügbarkeit 98 % Plasmaeiweißbindung 95 % Metabolismus Hepatisch, vorwiegend CYP3A4 Halbwertzeit 18–22 Stunden Ausscheidung Hepatisch Verabreichungsform Oral Schwangerschaft sorgfältige Nutzen-Risiko-Abwägung
(teratogen im Tierversuch)Imatinib wird hauptsächlich von dem Cytochrom P450-Isoenzym CYP3A4 verstoffwechselt, wobei das N-Desmethyl-Piperazin-Derivat als Hauptmetabolit mit Restaktivität entsteht. Inhibitoren dieses Isoenzyms (zum Beispiel Erythromycin, Cimetidin oder Grapefruitsaft) können die Metabolisierung von Imatinib hemmen und somit zu einer Erhöhung der Plasmakonzentrationen und in der Folge zu höherer Toxizität führen. Des Weiteren findet man N-Oxide am Piperazin- und am Pyrimidin-Ring sowie die Oxidation der aromatischen Methylgruppe zum Alkohol. Die Ausscheidung erfolgt größtenteils über die Galle (biliär), zu einem geringeren Teil über die Niere. Unverändert werden 25 % ausgeschieden. Imatinib ist kompetitiver Hemmstoff der Cytochrome CYP2C9, CYP2D6, CYP3A4/5. Der Zeitpunkt der maximalen Plasmakonzentration liegt bei 1 bis 2 Stunden.
Unerwünschte Wirkungen und Gegenanzeigen
Imatinib wird im Allgemeinen gut vertragen. Zu den unerwünschten Wirkungen zählen Übelkeit, Erbrechen, Durchfall, Muskelschmerzen (Myalgie), Muskelkrämpfe, Hautrötungen, erhöhte Leberwerte (Transaminasenanstieg), Schwellungen (Ödeme) und Hautveränderungen. Imatinib ist im Tierversuch teratogen und sollte deshalb während der Schwangerschaft nicht angewendet werden.
Entwicklung neuer Wirkstoffe
Für die Behandlung von Patienten, bei denen eine Imatinib-Resistenz oder -Unverträglichkeit vorliegt, werden zur Zeit (2006) neue Wirkstoffe entwickelt.
Dasatinib (BMS-354825)
Der von Bristol-Myers Squibb entwickelte Wirkstoff Dasatinib hat am 28. Juni 2006 in den USA unter dem Handelsnamen Sprycel® die Zulassung bekommen. Dasatinib soll in-vitro bis zu 300 mal wirksamer sein in seiner Hemmung von Kinasen. Im November 2006 hat die EU Dasatinib zur Behandlung von Patienten mit Ph-positiver CML und ALL, die unter Imatinib-Therapie eine Resistenz oder Unverträglichkeit entwickelt haben, zugelassen.
Nilotinib (AMN 107)
Auch der vom Imatinib-Hersteller Novartis neu entwickelte Tyrosinkinase-Inhibitor Nilotinib, soll nicht mehr nur an Bcr-Abl, sondern auch an 32 von 33 bekannten Mutationen ankoppeln und wirksam sein.
Im November 2007 wurde Nilotinib (Handelsname Tasigna®) nun EU-weit für die Behandlung von CML bei Vorliegen von Imatinib-Resistenz und Imatinibunverträglichkeit zugelassen.
SGX393
Lediglich bei der Mutation T315I wirkte bisher keiner der bekannten Tyrosinkinase-Hemmstoffe. Dabei liegt eine Genmutation vor, die zum Aminosäureaustausch Threonin → Isoleucin an Position 315 führt. Isoleucyl-Reste sind erheblich größer als Threonyl-Reste und verhindern so möglicherweise die Bindung des Pharmakons an die spezifische Bindungsstelle.
Forscher des Oregon Health & Science University Cancer Institute stellten nun im März 2008 mit dem noch experimentellen Tyrosinkinase-Inhibitor SGX393 von SGX Pharmaceuticals einen Wirkstoff vor, der in Labortests bei der Mutation T315I und verschiedenen anderen Mutationen Wirkung zeigte.
Auch SGX393 ist nicht bei allen Bcr-Abl-Mutationen wirksam. Der neue Wirkstoff kann jedoch in Kombination mit Dasatinib oder Nilotinib eingesetzt werden, wodurch die erfolgreiche Behandlung sämtlicher Imatinib-resistenter CML-Patienten in greifbare Nähe rückt.
Literatur
- Deininger, M. et al. (2005): The development of imatinib as a therapeutic agent for chronic myeloid leukemia. In: Blood. Bd. 105, S. 2640-2653. PMID 15618470
- O'Brien, SG et al. (2003): Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. In: N. Engl. J. Med. Bd. 348, S. 994–1004. PMID 12637609.
- Savage, D.G. & Antman, K.H. (2002): Imatinib Mesylate — A New Oral Targeted Therapy. In: N. Engl. J. Med. Bd. 346, S. 683–693. PMID 11870247
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.