- Americiumtrichlorid
-
Kristallstruktur 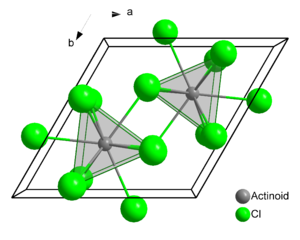
Kristallsystem hexagonal Raumgruppe 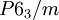
Gitterkonstanten a = 738,2 pm
c = 421,4 pmKoordinationszahlen Am[9], Cl[3] Allgemeines Name Americium(III)-chlorid Andere Namen Americiumtrichlorid
Verhältnisformel AmCl3 CAS-Nummer 13464-46-5 Kurzbeschreibung rosafarbene hexagonale Kristalle Eigenschaften Molare Masse 349,42 g/mol Aggregatzustand fest
Dichte 5,87 g/cm3[1]
Schmelzpunkt Siedepunkt 850 °C[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Americium(III)-chlorid ist ein Chlorid des künstlichen Elements und Actinoids Americium mit der Summenformel AmCl3. In diesem Salz tritt Americium in der Oxidationsstufe +3 auf.[4]
Inhaltsverzeichnis
Eigenschaften
Americium(III)-chlorid bildet rosafarbene hexagonale Kristalle. Seine Kristallstruktur ist isotyp mit Uran(III)-chlorid. In der Struktur werden die Americiumatome von je neun Chloratomen umgeben, als Koordinationspolyeder ergibt sich dabei ein dreifach überkapptes, trigonales Prisma mit den Gitterparametern a = 738 pm und c = 421 pm und zwei Formeleinheiten pro Elementarzelle.[2] Der Schmelzpunkt der Verbindung liegt bei 715 °C.
Das Hexahydrat (AmCl3·6 H2O) weist eine monokline Kristallstruktur auf mit: a = 970,2 pm, b = 656,7 pm und c = 800,9 pm sowie β = 93° 37'; Raumgruppe: P2/n.[5]
Verwendung
Americium(III)-chlorid kann in einer NaCl-Salzschmelze in Gegenwart von Americium leichter zu Americium(II)-chlorid reduziert werden. Dies kann zur Trennung des Americiums von Plutonium genutzt werden.[6][7]
Einzelnachweise
- ↑ a b c Americium(III)-chlorid bei www.webelements.com.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds, S. 15, CRC Press 1995, ISBN 0-8493-8671-3(Zugriff am 25. Juni 2008).
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ L. B. Asprey, T. K. Keenan, F. H. Kruse: "Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium", in: Inorg. Chem. 1965, 4 (7), 985–986; doi:10.1021/ic50029a013.
- ↑ John H. Burns, Joseph Richard Peterson: "The Crystal Structures of Americium Trichloride Hexahydrate and Berkelium Trichloride Hexahydrate", in: Inorg. Chem. 1971, 10 (1), 147–151; doi:10.1021/ic50095a029.
- ↑ Nuclear Energy Agency: Proceedings of the Workshop on Pyrochemical Separations, S. 276–277, OECD Publishing 2000, ISBN 9-26418443-0(Zugriff am 24. Juni 2008).
- ↑ Plutonium Processing In The Nuclear Weapons Complex, S. 21, Diane Publishing 1992, ISBN 1-56806568-X(Zugriff am 24. Juni 2008).
Literatur
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
Siehe auch
Wikimedia Foundation.
