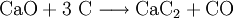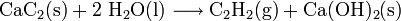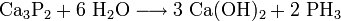- Kalziumkarbid
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Calciumcarbid Andere Namen - Kalziumkarbid
- Calciumacetylid
Verhältnisformel CaC2 CAS-Nummer 75-20-7 Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 64,10 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 2300 °C[1]
Löslichkeit in keinem Lösungsmittel löslich, mit Wasser erfolgt Zersetzung
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Leicht-
entzündlich(F) R- und S-Sätze R: 15 S: (2)-8-43 MAK 0,14 mg/m3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumcarbid, veraltet auch Calciumacetylid, ist das Calcium-Salz des Ethins und damit ein Acetylid. In reinem Zustand ist es ein weißer Feststoff.
Inhaltsverzeichnis
Geschichte
Calciumcarbid wurde erstmals 1836 von Edmund Davy sowie 1862 von Friedrich Wöhler dargestellt und 1862 von Marcellin Berthelot ausführlich beschrieben. Die labormäßige Calciumcarbid-Herstellung im elektrischen Ofen erfolgte 1892 durch Thomas L. Wilson in Amerika und durch Henri Moissan in Paris. Die industrielle Calciumcarbid-Gewinnung begann 1895 in der Aluminiumindustrie AG Neuhausen in der Schweiz; sie wurde im Jahre 1898 gleichzeitig in Norwegen und in Deutschland (Rheinfelden) aufgenommen.
Herstellung
Technisch wird Calciumcarbid im Lichtbogenofen bei 2500 °C aus Calciumoxid (Branntkalk) und Koks gewonnen, so dass die Herstellung durch den hohen Stromverbrauch sehr kostenintensiv ist.
Calciumcarbid gehört in der Gruppe der Carbide zu den Acetyliden, da es formal vom Ethin abgeleitet ist.
Die dabei entstehenden braunen Brocken enthalten 80–85 Prozent Calciumcarbid, der Rest besteht aus Verunreinigungen wie Calciumoxid, Calciumphosphid, Calciumsulfid, Calciumnitrid oder Siliciumcarbid.
Calciumcarbid reagiert mit Wasser unter Freisetzung von Ethin; als Rückstand entsteht schwer lösliches Calciumhydroxid:
Der unangenehme „Carbid“-Geruch wird bei dieser Reaktion nicht von dem gebildeten Gas Ethin verursacht, sondern ist auf Gase wie Monophosphan, Ammoniak und Schwefelwasserstoff zurückzuführen, die bei der Reaktion der Verunreinigungen mit Wasser entstehen. So entsteht Phosphan durch die Hydrolyse von im Calciumcarbid enthaltenem Calciumphosphid Ca3P2:
Verwendung
- Früher wurde Calciumcarbid in Karbidlampen mit Wasser versetzt, mit dem es zu brennbarem Ethin reagierte; das Ethin wurde angezündet und verbrannte mit heller Flamme. Dieses Verfahren wurde insbesondere in den Grubenlampen im Bergbau untertage verwendet.
- Herstellung von Kalkstickstoff
- Synthese von Ethin
- Zum Entschwefeln von Roheisen in der Stahlindustrie
- Ab ca. 1900 bis weit in die 1930er-Jahre hinein wurden speziell für diesen Zweck produzierte Karbidlampen auch als Fahrradbeleuchtung eingesetzt. Diese Karbid-Fahrradlampen leuchteten weit heller als entsprechende Öl- oder Kerzenlampen.
- Zur Bestimmung der Restfeuchte von Boden- oder Betonproben wird die Synthese von Ethin genutzt. Hierbei wird die Probe zusammen mit einer Ampulle Calciumcarbid und vier Stahlkugeln in eine genormte Stahlflasche gefüllt und mit einem Manometerkopf verschlossen. Die Flasche wird geschüttelt, wodurch die Probe weiter zerkleinert wird und die Calciumcarbidampulle zerbricht. Der durch die Reaktion von Calciumcarbid und Feuchtigkeit entstehende Gasdruck kann am Manometerkopf abgelesen und in den Feuchtegehalt umgerechnet werden. Dieses Verfahren wird als Carbid-Methode (CM) bezeichnet
- Calciumcarbid wird auch zur Bekämpfung von Wühlmäusen und Maulwürfen eingesetzt. Das wegen der Bodenfeuchte entstehende Ethin soll diese Tiere durch den unangenehmen Geruch vertreiben.
- Viele Speläologen verwenden bevorzugt Carbidlampen, da diese ein besonders schönes Licht geben.
Eigenschaften
In reinem Zustand ist Calciumcarbid eine farblose, kristalline Masse. Es existieren zwei Modifikationen, welche durch Erhitzen auf 440 °C (tetragonale Modifikation) und durch Erhitzen auf Temperaturen über 440 °C (kubisch flächenzentrierte Modifikation) zugänglich sind. Calciumcarbid ist in keinem Lösungsmittel (unverändert) löslich. Tritt es mit Wasser in Kontakt, so zersetzt es sich in einer lebhaften Reaktion zu Ethin und Calciumhydroxid. Bei Temperaturen oberhalb von 905 °C reagiert es mit Stickstoff unter Bildung von Calciumcyanamid, die Druckhydrierung liefert Calciumhydrid; seine reduzierenden Eigenschaften werden ebenfalls technisch genutzt.
Das Calciumcarbid des Handels ist durch beigemengte Kohlebestandteile grau bis grauschwarz oder durch Eisenoxid-Verunreinigungen braun gefärbt; daneben enthält es durch die Herstellung bedingt noch etwas Calciumoxid, Calciumphosphid, Calciumsulfid, Ferrosilicium, Magnesiumnitrid und Siliciumcarbid, so dass es durchschnittlich nur auf einen CaC2-Gehalt von 82 % kommt. Der unangenehme „Carbid-Geruch“ ist hauptsächlich auf Phosphorwasserstoff zurückzuführen, der aus den Calciumphosphid-Spuren durch Luftfeuchtigkeit freigemacht wird.
Siehe auch
Quellen
Wikimedia Foundation.