- Calciumhydroxid
-
Kristallstruktur 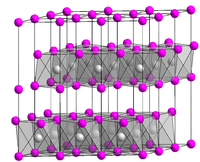
__ Ca2+ __ OH− Allgemeines Name Calciumhydroxid Andere Namen - Calciumdihydroxid
- Kalziumhydroxid
- Portlandit
- gelöschter Kalk
- Marmorkalkhydrat
- Calciumlauge (als wässrige Lösung)
- Kalkwasser (als wässrige Lösung)
- Kalkmilch (als wässrige Lösung)
- E 526
Verhältnisformel Ca(OH)2 CAS-Nummer 1305-62-0 Kurzbeschreibung farbloser, geruchloser Feststoff[1]
Eigenschaften Molare Masse 74,10 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Gefahr
H- und P-Sätze H: 318 EUH: keine EUH-Sätze P: 280-305+351+338-313 [2] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 41 S: 22-24-26-39 LD50 7340 mg·kg−1 (Ratte, oral)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumhydroxid (auch: gelöschter Kalk, Löschkalk, Kalkhydrat, Hydratkalk) ist das Hydroxid des Calciums.
Inhaltsverzeichnis
Vorkommen
Calciumhydroxid kommt in der Natur auch als Mineral Portlandit vor.
Gewinnung und Darstellung
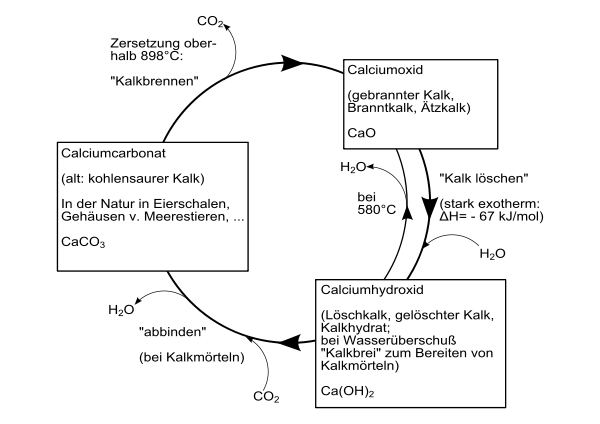
Calciumhydroxid entsteht unter starker Wärmeentwicklung (exotherme Reaktion) beim Versetzen von Calciumoxid mit Wasser.[3] Diesen Vorgang nennt man auch Kalklöschen. Die Wärmeentwicklung ist so stark, dass Teile des Wassers verdampfen (umgangssprachlich als „Rauchen“ bezeichnet).
Einen Überblick über die Umwandlungsprozesse zwischen verschiedenen Calciumverbindungen (Technischer Kalkkreislauf) gibt folgendes Schaubild:
Weiterhin ist die Darstellung durch Reaktion von wässrigen Calciumsalzlösungen mit Alkalilaugen möglich (zum Beispiel Calciumnitrat mit Kaliumhydroxid).[3]
Calciumhydrid oder Calcium selbst reagiert mit Wasser heftig unter Bildung von Calciumhydroxid und Wasserstoff.[4]
Eigenschaften
Calciumhydroxid ist ein farbloses Pulver, welches sich nur wenig in Wasser löst, wobei die Lösung stark basisch reagiert. Die Löslichkeit ist temperaturabhängig und sinkt bei steigender Temperatur: 1860 mg/l bei 0 °C; 1650 mg/l bei 20 °C und 770 mg/l bei 100 °C.[5] Bei 580 °C zersetzt es sich, wobei Calciumoxid und Wasser entstehen.[2] Calciumhydroxid besteht aus hexagonalen Kristallen mit einer Kristallstruktur vom Cadmiumiodid-Typ (a = 3,584, c = 4,896 A).[3]
Verwendung
Der Haupteinsatzzweck von Calciumhydroxid ist die Zubereitung von Mörtel im Bauwesen.[2] Es findet dort unter dem Namen Weißkalkhydrat Verwendung (DIN 1060). Kalkputze bestehen aus Mischungen von Calciumhydroxid, gemahlenem Kalkstein und Sand. Calciumhydroxid dient auch als Zwischenprodukt zur Herstellung von Chlorkalk und Natronlauge aus Soda.[2] Weiterhin wird es als Medikament in der Zahnmedizin verwendet, vor allem zur Desinfektion von Wurzelkanälen und Kavitäten. Es ist auch Bestandteil des Atemkalks, welche in Narkosegeräten oder Tauchgeräten mit Rückatmung zum Herausfiltern von Kohlenstoffdioxid aus der Ausatemluft verwendet wird. Eine weitere Verwendung findet Calciumhydroxid als Pflanzenschutzmittel im Obstbau. Hier wird es zum Beispiel als Fungizid (Pilzgift) gegen Obstbaumkrebs eingesetzt. Die ätzende Wirkung, welche auch diverse Krankheitserreger zerstört, ist der Grund, warum früher gelöschter Kalk zum Desinfizieren von Ställen (das „Kalken“ der Ställe) benutzt wurde. In der Lebensmittelindustrie wird es als Säureregulator Lebensmitteln zugesetzt und ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 526 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Der gelöschte Kalk wird unter anderem als Alternative zum Kalkstein in der Rauchgasentschwefelung eingesetzt, da es mit Schwefelsäure Calciumsulfat (Gips) bildet. Die Einsatzmenge ist hierbei ca. 1,8-fach geringer als für Kalkstein. Der dabei gewonnene Gips hat einen Weißgrad von 80 % und kann kommerziell weiterverwendet werden. Durch seine hohe Reaktivität werden geringere Verbrauchmengen benötigt. Nachteil ist sein deutlich höherer Preis gegenüber Kalkstein.
Kalk wird auch zur Verbesserung der Tragfähigkeit von Baugrund eingesetzt. Ein Boden mit zu hohem Wassergehalt und daraus resultierender geringer Tragfähigkeit, schlechter Verdichtbarkeit kann durch das Untermischen von 2–4 % MA Kalk verbessert werden. Der Kalk bindet einen Teil des Wassers und verbessert so unter anderem die Plastizität, die Verdichtbarkeit und die Tragfähigkeit. Deshalb ist die Bodenverbesserung mit Kalk ein Verfahren zur sofort erreichbaren Verbesserung der Einbaufähigkeit und Erleichterung der Ausführung von Bauarbeiten.
Kalkwasser ist die (nahezu) gesättigte Lösung von Calciumhydroxid und dient als klare Flüssigkeit dem Nachweis von Kohlenstoffdioxid.
Suspensionen in Wasser sind:
- Fettkalk (Sumpfkalk): eine cremig-steife Masse – Baustoff: Kalkmörtel
- Kalkmilch: eine weißliche, milchartige Flüssigkeit, die sich aber entmischt – Kalkfarbe, Neutralisation von Säuren, Entcarbonisierung, Rauchgasentschwefelung
Sicherheitshinweise
Gebrannter (ungelöschter) Kalk (Calciumoxid, Branntkalk) und gelöschter Kalk sind reizend, Kontakt mit den Augen kann zu ernsten Augenschäden führen.
Einzelnachweise
- ↑ a b c d e Datenblatt Calciumhydroxid bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c d e f Eintrag zu CAS-Nr. 1305-62-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Mai 2010 (JavaScript erforderlich)
- ↑ a b c Georg Brauer; Handbuch Der Präparativen Anorganischen Chemie, S. 926; ISBN 3-432-87813-3
- ↑ Roland Pfestorf,Heinz Kadner; Chemie: Ein Lehrbuch für Fachhochschulen, S.368; ISBN 978-3817117833
- ↑ Taschenbuch Chemische Substanzen, 3. Auflage, Harri Deutsch, Frankfurt a. M., 2007
ErdalkalimetallhydroxideBerylliumhydroxid | Magnesiumhydroxid | Calciumhydroxid | Strontiumhydroxid | Bariumhydroxid | Radiumhydroxid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Calciumhydroxid — Cạl|ci|um|hy|dro|xid auch: Cạl|ci|um|hyd|ro|xid 〈n. 11; fachsprachl.〉 = Kalziumhydroxid * * * Cal|ci|um|hy|d|r|o|xid; Syn.: (Jargon:) gelöschter Kalk, Löschkalk, (veraltet:) Kalkhydrat: Ca(OH)2; farblose krist. Masse, die sich bei der Reaktion… … Universal-Lexikon
Calciumhydroxid — Cạl|ci|um|hy|dro|xid auch: Cạl|ci|um|hyd|ro|xid 〈n.; Gen.: s; Pl.: unz.; Chemie〉 starke Base, entsteht durch Auflösen von gebranntem Kalk in Wasser; oV … Lexikalische Deutsches Wörterbuch
Ca(OH)2 — Kristallstruktur Ca2+ … Deutsch Wikipedia
Calciumdihydroxid — Kristallstruktur Ca2+ … Deutsch Wikipedia
Calciumlauge — Kristallstruktur Ca2+ … Deutsch Wikipedia
E526 — Kristallstruktur Ca2+ … Deutsch Wikipedia
E 526 — Kristallstruktur Ca2+ … Deutsch Wikipedia
Gelöschter Kalk — Kristallstruktur Ca2+ … Deutsch Wikipedia
Kalkhydrat — Kristallstruktur Ca2+ … Deutsch Wikipedia
Kalziumhydroxid — Kristallstruktur Ca2+ … Deutsch Wikipedia