- Lecimibid
-
Strukturformel 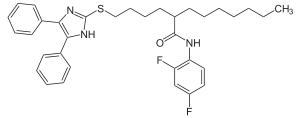
Allgemeines Freiname Lecimibid Andere Namen - 3-(2,4-Difluorphenyl)-1-[5- [(4,5-diphenylimidazol-2-yl)thio]pentyl]- 1-heptylharnstoff (IUPAC)
- N′-(2,4-Difluorphenyl)-N- (5-((4,5-diphenyl-1H-imidazol- 2-yl)thio)pentyl)-N-heptylharnstoff
- DuP 128
Summenformel C34H40F2N4OS CAS-Nummer 130804-35-2 PubChem 71355 Arzneistoffangaben Wirkmechanismus Acyl-CoA:Cholesterol-O-acyltransferase-Inhibitor
Eigenschaften Molare Masse 590,77 g·mol−1 Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lecimibid ist eine fluorhaltige chemische Verbindung aus der Gruppe der Imidazole. Der Arzneistoff Lecimibid hemmt selektiv in starker nicht-kompetitiver Weise die Acyl-CoA:Cholesterin-O-acyltransferase, kurz ACAT, mit einem IC50-Wert von 10 nM, gemessen an Mikrosomen aus der Rattenleber. Die Hauptfunktion dieses Enzyms ist die Veresterung des Cholesterins im Rahmen der intrazellularen Cholesterinhomeostasis und der Cholesterin-Resorption aus dem intestinalen Lumen (Darminnern).
Inhaltsverzeichnis
Eigenschaften
Lecimibid wird schlecht vom Körper absorbiert. Eine initiale Phase I-Studie zeigte 1994 nur einen geringen Effekt auf die Hemmung der Cholesterin-Absorption.[2] Dies stieß die weitere Suche nach ACAT-Inhibitoren mit höherer Bioverfügbarkeit an.
Während Lecimibid auf die ACAT-Homologen in der Hefe Saccharomyces cerevisiae keinen Effekt hat, hemmt es die humane ACAT in vitro.
Verwendung
Lecimibid befindet sich zurzeit in Studien, die auf eine Arzneimittelentwicklung als Cholesterolsenker abzielen.[3]
Nachweis
Für den Nachweis von Lecimibid und dessen Sulphon- und Sulphoxid-Metabolite in humanem Plasma wurde von C.M. Lai et al. eine HPLC-Methode mit Fluoreszenzdetektion beschrieben.[4]
Literatur
- Yang, Hongyuan et al.: Functional Expression of a cDNA to Human Acyl-coenzyme A:Cholesterol Acyltransferase in Yeast J. Biol. Chem. 1997 Feb 14;272(7):3980-5, PMID 9020103.
- King, F.D. und Oxford, A.W.: Progress in Medicinal Chemistry: Vol 39 Elsevier, 2002 ISBN 0-444-50959-3[5]
Pharmakologie:
- Burnett, J.R. et al.: Inhibition of cholesterol esterification by DuP 128 decreases hepatic apolipoprotein B secretion in vivo: effect of dietary fat and cholesterol. Biochim Biophys Acta. 1998 Jul 31;1393(1):63–79, PMID 9714740.
- Whitman, S.C. et al.: Modification of Type III VLDL, Their Remnants, and VLDL From ApoE-Knockout Mice by p-Hydroxyphenylacetaldehyde, a Product of Myeloperoxidase Activity, Causes Marked Cholesteryl Ester Accumulation in Macrophages Arterioscler Thromb Vasc Biol. 1999 May;19(5):1238–49, PMID 10323775.
Synthese und Analytik:
- Highley, C.A. et al.: Acyl CoA:cholesterol acyltransferase (ACAT) inhibitors: synthesis and structure-activity relationship studies of a new series of trisubstituted imidazoles J. Med. Chem. 1994 Oct 14;37(21):3511–22, PMID 7932580.
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Hainer, J.W. et al.: Effect of the acyl-CoA:cholesterol acyltransferase inhibitor DuP 128 on cholesterol absorption and serum cholesterol in humans Clin Pharmacol Ther. 1994 Jul;56(1):65-74, PMID 8033496.
- ↑ Datenbankrecherche der DIMDI / Medline Datenbank DIMDI.
- ↑ Lai, Chii-Ming Determination of DuP 128, an ACAT inhibitor and its sulphoxide and sulphone metabolites in human plasma by liquid chromatography J. Pharm. Biomed. Anal. 1994 Sep;12(9):1163-72, PMID 7803568.
- ↑ Eintrag bei http://books.google.de.

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.
