- Imidazol
-
Strukturformel 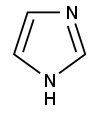
Allgemeines Name Imidazol Andere Namen - 1,3-Diazol
- 1,3-Diaza-2,4-cyclopentadien
- Glyoxalin
- Imutex
Summenformel C3H4N2 CAS-Nummer 288-32-4 PubChem 795 Kurzbeschreibung farblose Kristalle [1]
Eigenschaften Molare Masse 68,08 g·mol−1 Aggregatzustand fest
Dichte 1,03 g·cm−3 [1]
Schmelzpunkt Siedepunkt 257 °C [1]
pKs-Wert 6,95 (pKb, 25 °C) [2]
Löslichkeit gut löslich in Wasser (633 g·l−1 bei 20 °C), Ethanol, Chloroform, Diethylether und Pyridin [1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 


Gefahr
H- und P-Sätze H: 302-314-361d EUH: keine EUH-Sätze P: 280-301+330+331-305+351+338-309-310 [3] EU-Gefahrstoffkennzeichnung [3] 
Ätzend (C) R- und S-Sätze R: 22-34 S: 22-26-36/37/39-45 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Imidazol ist eine fünfgliedrige heterocyclische aromatische organische Verbindung mit zwei Stickstoffatomen. Es reagiert basisch und ist Bestandteil der Seitenkette der Aminosäure Histidin.
Inhaltsverzeichnis
Gewinnung und Darstellung
Erstmals hergestellt wurde Imidazol 1858 von Heinrich Debus durch die Reaktion von Glyoxal (Ethandial) mit Ammoniak NH3, woher der veraltete Name Glyoxalin stammt.[6]
Heute kann es nach der Radziszewski-Synthese durch Kondensation aus 1,2-Diketon, Ammoniak und einem Aldehyd dargestellt werden.
In neuerer Zeit sind weitere Wege der Synthese von Imidazolen und Benzimidazolen beschrieben worden.[7]
Eigenschaften und Toxikologie
Imidazol bildet farblose Kristalle, die sich gut in Wasser lösen. Der Heterocyclus besitzt sowohl basische, als auch saure Eigenschaften und ist daher ein Ampholyt. Auf Warmblüter wirkt Imidazol mit LD50-Werten zwischen 220 (Ratte)[4] und 880 mg/kg Körpergewicht (Maus)[5] mäßig toxisch; bei niederen Tieren besitzt es als Antimetabolit des Histidin und der Nicotinsäure eine deutlich höhere Giftigkeit und wird daher als Schädlingsbekämpfungsmittel verwendet.[6]
Verwendung
Imidazol wird hauptsächlich als Ausgangsprodukt bei der Herstellung verschiedener Medikamente verwendet, insbesondere von Fungiziden des Azoltyps (z B. Clotrimazol). Weiterhin findet es Verwendung bei der Aushärtung bestimmter Kunststoffe.
Ebenfalls wird das Imidazol als Puffersubstanz beim Karl-Fischer-Verfahren zur Wasserbestimmung verwendet. Eugen Scholz entwickelte 1984 das pyridinfreie Karl-Fischer-Reagenz mit Imidazol als Base. Dieses Reagenz ersetzt nicht nur das giftige und übelriechende Pyridin, sondern ermöglicht auch eine schnellere und genauere Titration, da Imidazol in einem günstigeren pH-Bereich puffert als Pyridin. Die Untersuchungen von Scholz zur Stöchiometrie zeigten auch, dass Methanol (Lösemittel und gleichzeitig an der Reaktion beteiligt) durch andere Alkohole ersetzt werden kann, z. B. Ethanol, 2-Propanol oder Methoxyethanol, die die Titerstabilität des Reagenzes verbesserten. Aufgrund dieser Erkenntnisse ergab sich folgende Reaktionsgleichung für die Karl-Fischer-Reaktion:
In der Biochemie wird Imidazol zur Elution von Proteinen verwendet, die mit einem Histidin-Tag (mehrere aufeinanderfolgende Histidine) versehen sind. Dabei werden die Proteine an einer Metallionenchelat-Matrix (IMAC) wie z.B. Ni2+-NTA gebunden und durch hohe Konzentrationen von Imidazol wieder von der Säule ausgewaschen.
Einzelnachweise
- ↑ a b c d e Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart, 1992.
- ↑ Imidazol bei ChemIDplus
- ↑ a b c Eintrag zu Imidazol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Feb. 2008 (JavaScript erforderlich)
- ↑ a b c Przeglad Epidemiologiczny. Vol. 67, Pg. 295, 1993.
- ↑ a b Deutsche Patentoffenlegungsschrift. Vol. #3046325
- ↑ a b Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, 2006, ISBN 3-906390-29-2, S. 483
- ↑ Imidazole Synthesis
Siehe auch
Kategorien:- Gesundheitsschädlicher Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Ätzender Stoff
- Imidazol
Wikimedia Foundation.



