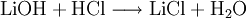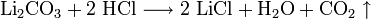- LiCl
-
Kristallstruktur 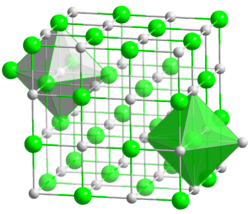
__ Li+ __ Cl- Kristallsystem kubisch Raumgruppe 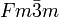
Koordinationszahlen Li[6], Cl[6] Allgemeines Name Lithiumchlorid Verhältnisformel LiCl CAS-Nummer 7447-41-8 PubChem 433294 Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 42,39 g·mol−1 Aggregatzustand fest
Dichte 2,07 g·cm−3[1]
Schmelzpunkt 615 °C[1]
Siedepunkt 1360 °C[1]
Löslichkeit gut in Wasser: 820 g·l−1 (20 °C), auch löslich in Methanol[1] und Pentanol
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/38 S: keine S-Sätze LD50 526 mg·kg−1[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumchlorid LiCl, das Lithiumsalz der Chlorwasserstoffsäure, bildet farblose, stark hygroskopische[2] Kristalle. Neben dem wasserfreien Lithiumchlorid existieren noch verschiedene Hydrate, bekannt sind LiCl · n H2O mit n= 1, 3 und 5.[3]
Inhaltsverzeichnis
Eigenschaften
Lithiumchloridlösungen sind stark hygroskopisch. Sie reduzieren den Wasserdampfdruck um ca. 90 %. Aus konzentrierten wässrigen Lösungen kristallisiert wasserfreies Lithiumchlorid erst bei Temperaturen oberhalb von 98 °C aus. Bei niedrigeren Temperaturen erhält man eine der Hydratformen. Die Löslichkeit in Wasser beträgt ca. 450 g LiCl/kg Lösung. Gasförmiges Lithiumchlorid bildet planare Ringe aus mehreren Lithiumchloridmolekülen (Di-, Tri- und Oligomere).
Lithiumchloridlösungen sind sehr korrosiv. Zur Handhabung konzentrierter Lösungen sind geeignete Werkstoffe auszuwählen. Lithiumchloridlösungen schädigen auch Beton.
Darstellung
Die Gewinnung von Lithiumchlorid erfolgt durch Umsetzung einer wässrigen Lithiumhydroxid- oder Lithiumcarbonatlösung mit Chlorwasserstoff und anschließender Aufkonzentrierung und Trocknung.
Technisch relevant ist zurzeit nur die Umsetzung von Lithiumcarbonat mit Salzsäure mit anschließender Einengung unter Kristallisation von Lithiumchlorid in Vakuumverdampfern.
Außerdem fällt Lithiumchlorid häufig bei metallorganischen Synthesen als Nebenprodukt an (Salzmetathese).
Verwendung
Lithiumchlorid kann zur Herstellung von Lithium benutzt werden. Hierzu wird eine Mischung aus Lithiumchlorid und Kaliumchlorid in einer Schmelzflusselektrolyse eingesetzt.[4] Wegen der stark hygroskopischen Wirkung kann es als Trocknungsmittel und auch zur Raumentfeuchtung verwendet werden.[5][6] Des Weiteren kann es als Flussmittel in der Löt- und Schweißtechnik eingesetzt werden.[6] Auf Grund seiner Hygroskopie kann es in Taupunktsensor oder -hygrometer verwendet werden. Die elektrische Leitfähigkeit des Salzes ist stark abhängig von der Wasserkonzentration, weshalb die Umgebungsfeuchte aus der Leitfähigkeit des Lithiumchlorids bestimmt werden kann.[5] In chemischen oder geologischen Untersuchungen kann Lithiumchlorid als Tracer eingesetzt werden.[7] Lithiumchlorid kann in Enteiserlösungen verwendet werden. Da diese jedoch korrosiv sind, sind sie beispielsweise zur Anwendung an Fluggeräten in den USA verboten.[8] Auch die Textilindustrie verwendet Lithiumchlorid.[9] In Kältebäder können Lithiumchloridlösungen mit 25–30 % LiCl zum Einsatz kommen. Solche Kältebäder können bis −70 °C flüssig bleiben.[10]
Quellen
- ↑ a b c d e Sicherheitsdatenblatt (carl-roth)
- ↑ a b Eintrag zu Lithiumchlorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8.11.2007 (JavaScript erforderlich)
- ↑ A. Hönnerscheid, J. Nuss, C. Mühle, M. Jansen: Die Kristallstrukturen der Monohydrate von Lithiumchlorid und Lithiumbromid, in: Zeitschrift für Anorganische und Allgemeine Chemie 2003, 629, 312–316.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 386–387.
- ↑ a b Skript Universität Duisburg-Essen
- ↑ a b Skript Universität Karlsruhe
- ↑ Skript Universität von Colorado
- ↑ [1]
- ↑ Patent DE 19638319C1 1998
- ↑ Seilnacht.de
Wikimedia Foundation.