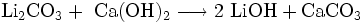- LiOH
-
Strukturformel 
Allgemeines Name Lithiumhydroxid Summenformel LiOH CAS-Nummer 1310-65-2 Kurzbeschreibung weiße Kristalle oder Pulver Eigenschaften Molare Masse 23,95 g·mol–1 Aggregatzustand fest
Dichte 1,46 g·cm–3[1]
Schmelzpunkt 450 °C[1]
Siedepunkt 924 °C[1]
Löslichkeit mäßig löslich in Wasser (71 g/l Lösung bei 20 °C)[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 20/22-34 S: 9-20-26-36/37/39-45-60 LD50 210 mg/kg[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumhydroxid LiOH, das Hydroxid des Lithiums, ist zwar eine starke, in Wasser aber nur mäßig lösliche Base.
Inhaltsverzeichnis
Synthese
Reines Lithiumoxid Li2O reagiert mit Wasser zu Lithiumhydroxid. Die technische Herstellung erfolgt durch Umsetzung von Lithiumcarbonat mit Calciumhydroxid:[3]
Reaktionsverhalten
Lithiumhydroxid ist eine starke Base und reagiert als solche mit Säuren. Außerdem ist Lithiumhydroxid fähig, Kohlenstoffdioxid zu binden (1 g wasserfreies Lithiumhydroxid bindet 450 ml CO2[4]).
Verwendung
Der größte Teil des Lithiumhydroxids wird für die Herstellung von Lithiumstearaten benötigt, die wichtige Schmierfette für Autos oder Flugzeuge sind. Weiterhin wird es auf Grund seiner Kohlenstoffdioxid-bindenden Wirkung als Luftreiniger eingesetzt. Dies spielt vor allem in der Raumfahrt und auf U-Booten eine Rolle. Lithiumhydroxid kann Zement zugesetzt werden und ist dabei in der Lage, die Alkali-Kieselsäure-Reaktion zu Unterdrücken. Weiterhin ist Lithiumhydroxid ein möglicher Zusatzstoff in Nickel-Eisen-Akkus.[3]
In Druckwasserreaktoren wird Lithiumhydroxid dem Primärkreislauf zugesetzt, um die gleichzeitig Borsäure zu neutralisieren und einen pH-Wert von etwa 7,2 zu erreichen.[5]
Weitere Anwendungsgebiete sind Fotoentwickler, keramische Erzeugnisse und die Herstellung von Boraten.[4]
Quellen
- ↑ a b c d e Sicherheitsdatenblatt (alfa-aesar)
- ↑ Eintrag zu Lithiumhydroxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8.11.2007 (JavaScript erforderlich)
- ↑ a b U. Wietelmann, R. Bauer: Lithium and Lithium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry, 2000, doi:10.1002/14356007.a15_393
- ↑ a b Lithiumhydroxid. In: Römpp-Chemielexikon, Thieme Verlag, 2008.
- ↑ H.-G. Heitmann: Chemische Belange in Kernkraftwerke. In: Chemie Ingenieur Technik - CIT, 1976, 48, 2, S. 124-129, doi:10.1002/cite.330480210.
Weblinks
Wikimedia Foundation.