- Lucas-Reagenz
-
Das Lucas-Reagenz dient in der organischen Chemie zur Unterscheidung von primären, sekundären und tertiären Alkoholen mit niedriger Molarer Masse. Beim sogenannten Lucas-Test (auch Lucas-Probe) reagieren die Alkohole abhängig von der Stellung der Hydroxylgruppe im Molekül des Alkohols unterschiedlich schnell oder gar nicht.
Inhaltsverzeichnis
Das Reagenz
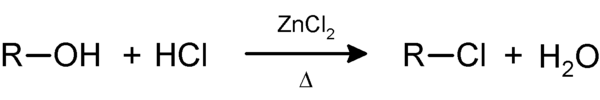
Als Lucas-Reagenz (nach Howard J. Lucas benannt) bezeichnet man eine Lösung von Zinkchlorid in konzentrierter Salzsäure. Diese Mischung war bereits vor der Publikation seines Test von Norris und Taylor [1] für andere Zwecke benutzt worden, wie Lucas selbst schreibt[2].
Lucas-Test
Zur Durchführung des Lucas-Tests wird eine Probe des zu testenden Alkohols in ein Reagenzglas vorgelegt, schnell das Lucas-Reagenz zugegeben und geschüttelt.
Dabei reagieren die verschiedenen Alkohole abhängig von der Stellung der Hydroxylgruppe im Molekül;
- Primäre Alkohole (=das Kohlenstoffatom der Hydroxylgruppe ist mit maximal einem weiteren Kohlenstoffatom verbunden) reagieren auch nach längerer Zeit nicht; die Lösung bleibt klar (Beispiele: Ethanol oder 1-Propanol),
- Sekundäre Alkohole (=das Kohlenstoffatom der Hydroxylgruppe ist mit zwei weiteren Kohlenstoffatomen verbunden) reagieren innerhalb von fünf Minuten, indem eine Trübung der Lösung auftritt und sich allmählich eine zweite Phase bildet (Beispiele 2-Propanol),
- Tertiäre Alkohole (=das Kohlenstoffatom der Hydroxylgruppe ist mit drei weiteren Kohlenstoffatomen verbunden) reagieren augenblicklich, die Flüssigkeit bildet zwei Phasen aus (Beispiel: 2-Methyl-2-propanol oder tert-Butylalkohol).
Die Reaktionszeit ist umso länger, je kleiner das Verhältnis von Reagenz zu Alkohol ist und je tiefer die Temperatur ist. Deshalb ist es für einen genauen Test nötig die Temperatur von 26 bis 27°C und das Verhältnis von Reagenz zum Alkohol einzuhalten.
Erklärung der Reaktion
Niedermolekulare Alkohole lösen sich sehr gut in Wasser und auch dem Lucas-Reagenz. Je nach Stellung der Hydroxylgruppe reagieren die Alkohole mit dem Reagenz, indem die OH-Gruppe durch ein Chloratom substituiert wird. Die reaktionsträgen primären Alkohole reagieren nicht merklich, und die Lösung bleibt klar. Sekundäre Alkohole reagieren in wenigen Minuten, und der entstehende Chlorkohlenwasserstoff trübt zunächst die Lösung und scheidet sich dann als wasserunlösliche Phase ab. Die wesentlich reaktiveren tertiären Alkohole zeigen augenblicklich eine Trübung und Phasentrennung:
Ausnahmen
Ausnahmen bilden Benzylalkohol und Allylalkohol, bei denen die Reaktion, den tertiären Alkoholen gleich, sofort eintritt. Beim Allylalkohol kommt noch dazu, dass durch die Löslichkeit des entstehenden Allylchlorids im Lucas-Reagenz die Trübung ausbleibt. Höhere Alkohole, ab sieben Kohlenstoffatomen, sind selbst nicht mehr gut wasserlöslich, so dass sich auf jeden Fall zwei verschiedene Phasen ausbilden, ohne dass das Lucas-Reagenz getrübt wird.
Einzelnachweise
Literatur
- Heinz G. O. Becker: Organikum: organisch-chemisches Grundpraktikum. 22. Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3 (bearbeitet von Rainer Beckert).
- Unterscheidung von primären, sekundären und tertiären Alkoholen. Lehramt Chemie - Dr. Reiß an der Philipps-Universität Marburg. (Zugriff am 27. Januar 2009)
Wikimedia Foundation.