- Mpemba-Effekt
-
Der Mpemba-Effekt bezeichnet das paradoxe Phänomen, bei dem heißes Wasser unter bestimmten Bedingungen schneller gefriert als kaltes Wasser. Benannt wurde der Effekt nach seinem „Wiederentdecker“ (1963), dem tansanischen Schüler Erasto B. Mpemba.
Definition
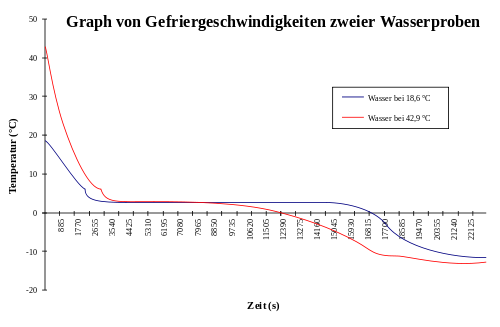
Kühlt man gleiche Ausgangsmengen warmen und kalten Wassers in gleichen Gefäßen unter demselben Druck und denselben Umgebungsbedingungen unter eine Temperatur ab, die dem Gefrierpunkt von Wasser bei diesem Druck entspricht (0 °C bzw. 273,15 K bei einem Druck von 101,325 kPa), so kann man in einem bestimmten Bereich von Abkühlungsgeschwindigkeiten beobachten, dass das zu Versuchsbeginn wärmere Wasser zu einem früheren Zeitpunkt gefriert (kristallisiert), als das ursprünglich kühlere Wasser. Dieses paradoxe Phänomen wird als Mpemba-Effekt bezeichnet.
Die uneingeschränkte Aussage, wonach heißes Wasser schneller gefriert als kaltes Wasser, ist jedoch falsch, da der Mpemba-Effekt nur in speziellen thermodynamischen Systemen auftritt.
Erstmalige Entdeckung
Beschrieben wurde dieses Phänomen bereits im vierten vorchristlichen Jahrhundert von Aristoteles (Μετεωρολογικά, I, 12); später wieder von Roger Bacon und René Descartes. 1963 stieß auch der tansanische Schüler Erasto B. Mpemba auf diesen Effekt, als er Speiseeis herstellte. Zusammen mit Dr. Denis G. Osborne veröffentlichte er 1969 die Ergebnisse zahlreicher Versuche zu diesem Thema. Jedoch dauerte es einige Jahre, bis dieser Effekt wissenschaftlich untersucht wurde.
Ursache
Die Ursache dieses Paradoxons ist noch nicht vollständig wissenschaftlich erklärt. Es gibt jedoch Theorien, welche zum einen die wesentliche Ursache darin sehen, dass die Menge des wärmeren Wassers beim Abkühlen in einem offenen System durch Verdunstung im Vergleich zur Menge des kühleren Wassers überproportional abnimmt. Dies liegt daran, dass der Dampfdruck einer Flüssigkeit (zu dem wiederum die Geschwindigkeit der Verdampfung proportional ist) exponentiell mit der Temperatur ansteigt. Das heißt, dass bezogen auf die gleiche Zeiteinheit mehr heißes als kaltes Wasser verdampft (Augustsche Dampfdruckformel). Dadurch liegen beim Erreichen des Gefrierpunktes immer unterschiedliche Wassermengen vor, und zwar derart, dass die Menge des ursprünglich wärmeren Wassers immer kleiner ist als die Menge des ursprünglich kühleren Wassers, und eine geringere Wassermenge gefriert bei ansonsten gleichen Bedingungen immer schneller als eine größere Wassermenge.
Zum anderen gibt es die Theorie, dass im Wasser gelöste Salze (Carbonate) bei hohen Temperaturen ausfallen und so keinen Einfluss mehr auf den Gefrierpunkt haben. Im kalten Wasser wächst die Konzentration der Salze im nach Kristallisationsbeginn noch flüssigen Wasser. Dies führt zu einer Gefrierpunktserniedrigung, da die Entropie im Wasser erhöht ist und dadurch die Bildung der hochgeordneten kristallinen Eisstruktur erschwert wird.
Der Mpemba-Effekt tritt jedoch nur bei bestimmten thermodynamischen Bedingungen und längst nicht immer auf. Er tritt auf, wenn die Parameter des Systems so gewählt sind, dass die ungleichförmige Abnahme der flüssigen Wassermengen beim Abkühlen und der daraus resultierende schnellere Kristallisationsprozess der geringeren verbleibenden Wassermenge die Geschwindigkeit des Gesamtvorgangs (Abkühlung plus Kristallisation) bestimmen.
Obwohl der ungleichmäßige Stoffmengenverlust der Systeme beim Abkühlen und der Entzug der gelösten Salze in der Regel die wesentliche Ursache des Effektes sind, gibt es dennoch keine Übereinstimmung in der wissenschaftlichen Diskussion darüber, ob nicht auch andere Effekte unter speziellen experimentellen Bedingungen einen ebenso großen Einfluss haben können. Dieser Punkt ist bis heute strittig und kann, auch aufgrund des spärlich vorliegenden und teilweise mit methodischen Mängeln behafteten Datenmaterials, nicht eindeutig beantwortet werden. Möglicherweise können unter speziellen experimentellen Bedingungen auch andere Effekte eine Rolle spielen. Im folgenden wird im Wesentlichen die Verdunstung betrachtet, da diese in aller Regel ausschlaggebend für das Eintreten des Mpemba-Effektes ist.
Mpemba-Effekt und thermodynamische Systeme
Offenes System
Der Mpemba-Effekt tritt in aller Regel nur in offenen physikalischen Systemen auf. Charakteristisch für offene Systeme ist ein möglicher Stoff- und Wärmeaustausch des Systems mit seiner Umgebung, wobei die Umgebung im Falle eines offenen Systems per Definition nicht in die Massen- und Energiebilanz des Gesamtsystems miteinbezogen wird (oder anders ausgedrückt: die Umgebung ist kein relevanter Bestandteil des offenen Systems). Beispiel: Das aus einem offenen Becherglas verdampfende Wasser entweicht in die Atmosphäre. Dadurch nimmt sowohl die Wassermenge im Glas als auch die im Wasser enthaltenen Wärmemenge ab, während gleichzeitig der Wasser- und Energiegehalt der Atmosphäre zunimmt. Diese Zunahme wird aber nicht berücksichtigt beziehungsweise quantifiziert.
Thermodynamisch gesehen werden bei Experimenten in offenen Systemen mehrere intensive (massenunabhängige) und extensive (massenabhängige) Größen gleichzeitig verändert, wodurch die Messung und Interpretation von beobachteten Effekten naturgemäß erschwert wird.
Geschlossenes System
In geschlossenen physikalischen Systemen kann der Mpemba-Effekt nicht auftreten, wobei man berücksichtigen muss, dass auch hier Wasser verdunsten kann.
In einem geschlossenen System kann das bei höherer Temperatur vermehrt verdampfende Wasser dem System nicht entweichen, sondern kondensiert beim Abkühlen wieder in dem Maße, wie es seinem Dampfdruck bei der jeweiligen im System herrschenden Temperatur und dem jeweiligen herrschenden Druck entspricht. Die Wassermengen bleiben in beiden Teilsystemen (wärmeres und kühleres Wasser) konstant, lediglich das Verhältnis von flüssigem zu gasförmigem Wasser ist zeitweise unterschiedlich. Die zur Verdampfung des Wassers notwendige Verdampfungswärme, die dem flüssigen Wasser selbst entzogen wird, entweicht dem System nicht (wie im Falle des offenen Systems) sondern wird beim Abkühlen und Kondensieren in Form von Kondensationswärme wieder frei.
Dadurch benötigt das anfänglich wärmere Wasser in einem geschlossenen System immer länger zu seiner Abkühlung als das anfänglich kühlere Wasser, das heißt das wärmere Wasser kann das kühlere bei der Abkühlung nicht „überholen“, wie es im Falle des offenen Systems geschehen würde. Der Mpemba-Effekt tritt damit nicht auf.
Wesentliche Einflussparameter
Folgende Parameter sind in einem offenen System von wesentlicher Bedeutung:
- Die anfänglichen absoluten Wassermengen
Diese dürfen nicht zu klein sein, damit das Wasser nicht vollständig verdunstet ist, bevor es den Gefrierpunkt erreicht hat.
- Die anfänglichen absoluten Temperaturen der jeweiligen Wassermengen
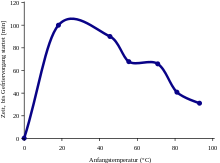
Dabei begünstigt eine große Temperaturdifferenz zwischen wärmerem und kälterem Wasser den Mpemba-Effekt dadurch, dass überproportional mehr wärmeres Wasser verdampfen kann. Allerdings darf die Temperatur des kühleren Wassers auch nicht zu nahe am Gefrierpunkt liegen, da das heißere System sonst nicht die Möglichkeit hat, das kühlere beim Abkühlen zu "überholen".
- Die Oberfläche des Wassers
Die Größe der Phasengrenzfläche zwischen flüssiger und gasförmiger Phase bestimmt die pro Zeiteinheit verdampfende Wassermenge (Verdampfungsgeschwindigkeit), da diese der Größe der Oberfläche proportional ist, sofern das Wasser nicht siedet. Die Oberflächengröße wiederum ist von der Gefäßform abhängig. Für die Beobachtung des Mpemba-Effekts ist eine große Oberfläche, die zu einem hohen Stoffmengenverlust durch Verdampfung führt, günstig.
- Die Umgebungstemperatur bzw. die Temperatur des sogenannten Wärmereservoirs
Die absolute Temperaturdifferenz zwischen den anfänglichen Wassermengen und dem Reservoir bestimmt den Verlauf der Abkühlungskurve. Je größer die Differenz, desto steiler verlaufen die Abkühlungskurven, d.h. umso schneller kühlen die Proben allein durch Wärmeleitung und Wärmestrahlung ab und umso geringer ist der Stoffmengenverlust durch Verdampfung. Für die Beobachtung des Mpemba-Effekts ist deshalb eine Temperatur des Reservoirs knapp unterhalb des Gefrierpunkts von Wasser günstig, da die Reservoirtemperatur so einerseits tief genug für die Kristallisation des flüssigen Wassers ist, andererseits jedoch die Abkühlungskurven der flüssigen Phasen hinreichend flach verlaufen und eine maximale Wassermenge während der Abkühlung der flüssigen Phasen verdampfen kann.
- Der Wärmeleitfähigkeitskoeffizient des Gefäßes
Dieser bestimmt, in welchem Maße die Abkühlung des Wassers über die Gefäßwand erfolgen kann. Je größer der Koeffizient, umso schneller kühlt das Wasser durch Wärmeableitung und Wärmestrahlung über das Gefäß ab. Für die Beobachtung des Mpemba-Effekts ist ein geringer Wärmeleitfähigkeitskoeffizient des Gefäßes insofern günstig, da dann mehr Wasser während des Abkühlens der flüssigen Phasen verdampfen kann, andererseits erschwert ein zu geringer Wärmeleitfähigkeitskoeffizient die Wärmeabführung der Kristallisationswärme über die Gefäßwand beim Gefrieren, was den Effekt wieder vermindert. Im praktischen Versuch sollten also beispielsweise keine Isoliergefäße verwendet werden.
Es bedarf noch wissenschaftlicher Versuche, ob und inwieweit der Mpemba-Effekt in gleicher oder vergleichbarer Weise sein paradoxes Ergebnis erzielt, wenn die beiden gefüllten Behälter auf Meereshöhe oder z.B. auf 7000 Metern Höhe und/oder sie am 45sten Grad nördlicher Breite oder an einem der beiden Pole aufgestellt werden. Der Siedepunkt und auch der Gefrierpunkt in Grad Celsius bzw. der jeweils zugehörige Druck der Luftsäule am Ort der Messung gehören u.a. hochwahrscheinlich zu den "bestimmenden Bedingungen" für das Messergebnis. Da Wasser viel Sauerstoff enthält, könnte naheliegen, daneben auch den Bezug zu der mit Höhe ü. N/N variierenden (sinkenden) Konsistenz des Sauerstoffgehalts in der Luft herzustellen. Die Testreihen könnten zu einem breakeven-Punkt führen, an welcher Stelle sich das Paradoxon auflöst und beide Wasserproben regelmäßig zu gleicher Zeit gefrieren.
Störparameter
Folgende Parameter sind für das Eintreten des Mpemba-Effektes nicht entscheidend, wenngleich sie ihn in verstärkender (positiver) oder abschwächender (negativer) Form zu stören vermögen. Deswegen sollten sie bei der Betrachtung von vornherein durch eine geeignete Wahl der Bedingungen ausgeschaltet werden. Unter besonderen experimentellen Bedingungen allerdings wird ein nicht vernachlässigbarer Beitrag dieser Effekte zum Mpemba-Effekt diskutiert.
Unterkühlte Flüssigkeiten bzw. Schmelzen
Kühlt man sehr reine Flüssigkeiten unter ihren Gefrierpunkt ab, so kann die Kristallisation ausbleiben, wenn keine Kristallisationskeime in der Flüssigkeit vorhanden sind. Zur Vermeidung kann man den Wasserproben einige Körnchen Quarzsand als Kristallisationsmatrix hinzufügen. Entgegen einer verbreiteten Ansicht ist die Konzentration (d. h. Menge) an Kristallisationskeimen für jeden Kristallisationsprozess bedeutungslos, entscheidendend ist lediglich, ob es mindestens einen geeigneten Kristallisationskeim gibt oder nicht. Die Gefrierpunktserniedrigung durch fehlende Kristallisation ist im übrigen unabhängig von der Tatsache, dass sich der Gefrierpunkt einer Flüssigkeit in Abhängigkeit von Druck und Volumen des Systems sowohl zu niedrigeren als auch zu höheren Werten hin verschieben kann (siehe dazu: Phasendiagramme von Einkomponentensystemen).
Prinzipiell wirkt sich der Effekt der unterkühlten Flüssigkeit aufgrund fehlender Kristallisationskeime nicht auf den Mpemba-Effekt aus, da er die ursprünglich kühlere Probe genauso betrifft, wie die ursprünglich wärmere. Sofern man allerdings unterstellt, dass das ursprünglich wärmere Wasser potentielle Kristallisationskeime – beispielsweise durch Ausgasen gelöster Fremdbestandteile wie Kohlendioxid – im Vergleich zum ursprünglich kühleren Wasser verliert, so würde der Effekt der unterkühlten Flüssigkeiten den Mpemba-Effekt abschwächen, da das ehedem heißere Wasser nun gerade nicht schneller gefrieren würde, sondern zur Unterkühlung neigte.
Temperaturgradienten
Temperaturunterschiede im System werden auch durch Temperaturgradienten angegeben. In einer unbewegten Flüssigkeit treten beim Abkühlen ebenso wie in der unbewegten Umgebung, Temperaturdifferenzen auf. So ist beispielsweise die Temperatur an den Gefäßwänden und an der Phasengrenze geringer als im Inneren der Phase, in der Umgebung ist die Temperatur in der Nähe der Gefäße höher als in weiterer Entfernung von diesen. In unterschiedlich warmen Ausgangsgefäßen treten beim Abkühlen unterschiedliche Gradientenverläufe auf, die praktisch gleichbedeutend mit einer Änderung des Wärmeleitfähigkeitskoeffizienten des Gefäßes sind. Dieser Effekt wird durch das Rühren der Flüssigkeiten (z. B. Magnetrührer) während des Abkühlens und einem Gebläse im Reservoir, welches eine konstante und gleichförmige Reservoirtemperatur sicherstellt, vermieden.
Gelöste Fremdstoffe
Gelöste Stoffe (dazu gehören auch gelöste Gase) können den Gefrierpunkt einer Flüssigkeit erniedrigen (Raoultsches Gesetz), wobei die Gefrierpunkterniedrigung dem Fremdstoffmengenanteil proportional ist. Im Falle von gelösten Gasen (z. B. Kohlendioxid in Wasser) ist die Konzentration an gelöstem Gas wiederum temperaturabhängig (Dampfdruck!), das heißt die unterschiedlich warmen Wasserproben enthalten unter Gleichgewichtsbedingungen unterschiedliche Mengen gelöster Gase und haben damit auch einen geringfügig unterschiedlichen Gefrierpunkt. Der Effekt ist allerdings sehr klein (im Bereich von 0,01 K bis 0,001 K) und spielt damit praktisch für den Mpemba-Effekt keine Rolle. Der Einfluss gelöster Gase würde den Mpemba-Effekt verstärken, da das anfänglich heißere Wasser weniger gelöste Fremdbestandteile enthielte und darum sein Gefrierpunkt im Vergleich zum anfänglich kühleren Wasser weniger herabgesetzt wäre. Insgesamt vermeidet man diesen „Schmutzeffekt“, indem man für den Versuch entgastes Wasser (durch vorheriges Aufkochen und Anlegen eines Vakuums) verwendet. Analoges gilt auch für Volumen- und andere Effekte, die durch ausfrierende Gasbläschen verursacht werden könnten.
Sonstige Parameter
Wasserdampfpartialdruck
Der Wasserdampfpartialdruck in der gasförmigen Phase muss im Vergleich zum Sättigungsdampfdruck klein sein, da sonst kein beziehungsweise weniger Wasser verdampfen kann. Diese Bedingung ist in der Regel bei der Versuchsdurchführung in trockener Umgebung gewährleistet. Ein hoher Wasserdampfpartialdruck in der gasförmigen Phase eines offenen Systems würde den Mpemba-Effekt abschwächen.
Einflusslose Parameter
Druckabhängigkeit des Gefrierpunkts
Der exakte Gefrierpunkt von reinem Wasser ist wie bei jeder Flüssigkeit beziehungsweise Schmelze druckabhängig. Der genaue Wert kann dem sogenannten Phasendiagramm des Wassers entnommen werden. Bei Normaldruck (p = 1013,25 hPa) entspricht der Gefrierpunkt T = 0,000°C bzw. T = 273,150 K. Der Tripelpunkt des Wassers befindet sich bei den Bedingungen T = 0,010°C bzw. T = 273,160 K und p = 611,657 Pa (ca. 6 hPa). Bei anderen Drücken kann der Gefrierpunkt über oder unter diesem Wert für den Gefrierpunkt liegen. Diese Tatsache ist unabhängig von Gefrierpunktserniedrigungen durch gelöste Fremdbestandteile und unterkühlten Schmelzen aufgrund fehlender Kristallisationskeime.
Mikroskopische Struktur der Flüssigkeit
Der Mpemba-Effekt ist vollständig im Rahmen der klassischen Wärmelehre erklärbar. Mikroskopische Eigenschaften wie etwa die Struktur von Flüssigkeiten sind, abgesehen von ihrer Bedeutung für die kalorischen Daten der betrachteten Substanz, ohne Einfluss.
Andere Flüssigkeiten
Der Mpemba-Effekt ist nicht auf Wasser beschränkt, also keine Anomalie des Wassers. Ob er auftritt, wird hauptsächlich durch die kalorischen Daten einer Substanz bestimmt. So weisen auch andere Substanzen wie etwa Ethanol, Essigsäure, Benzol oder Hexan eine ähnliche exponentielle Abhängigkeit des Dampfdrucks von der Temperatur auf. Allerdings liegen die Gefrierpunkte dieser Substanzen entweder wesentlich tiefer als die von Wasser, so dass der praktische Versuch höhere experimentelle Anforderungen an die notwendige Kühlung stellt, oder sie sind giftig oder entzündlich, so dass sich das Verdampfen in offenen Systemen ohne besondere Schutzmaßnahmen verbietet.
Nutzung des Mpemba-Effekts
Korrekterweise müsste man den Mpemba-Effekt als den Effekt bezeichnen, bei dem weniger heißes Wasser schneller gefriert als mehr kaltes Wasser. Dies ist der Grund, warum eine Nutzung des Effektes sowohl aus Gründen der Energiebilanz als auch aus Gründen der Kinetik sinnlos ist.
Energiebilanz
Die Energiebilanz bei Nutzung des Mpemba-Effekt stellt sich so dar, dass zuerst Energie aufgewendet wird, um ein System zu erwärmen und anschließend, um es wieder abzukühlen. Der Energieanteil, der für das Erwärmen über die Ausgangstemperatur hinaus und das anschließende Abkühlen bis zur Ausgangstemperatur zurück aufgewendet wird, ist energetisch gesehen verschwendet, unabhängig davon, ob es sich um ein offenes System (ein Teil der aufgewendeten Energie wird zur Verdampfung von Wasser bei konstantem Druck benutzt) oder ein geschlossenes System (ein Teil der aufgewendeten Energie wird zur Verdampfung von Wasser unter Druckerhöhung benutzt) handelt. Energetisch gesehen ist von vorne herein nur die Kühlung optimal.
Kinetik
Aber auch unter kinetischen Gesichtspunkten ist die Nutzung des Mpemba-Effekt sinnlos, wenn man davon ausgeht, dass das Ziel in diesem Fall darin besteht, eine beliebige anfängliche Menge (Masse) Wasser so schnell wie möglich zur Kristallisation zu bringen um eine genau definierte Menge (Masse) Eis zu produzieren. In diesem Fall wählt man eine angemessene Anfangsmenge Wasser und kühlt diese ab. Dies ist immer die absolut schnellste Methode. Wird eine ausreichende Anfangsmenge heißen Wassers benutzt, die nach Kristallisation die gleiche Menge Eis entstehen lässt wie im erstgenannten Fall, so tritt der Mpemba-Effekt nicht ein, denn die Eisbildung braucht jetzt insgesamt länger. Wird dagegen die gleiche Ausgangsmenge Wasser eingesetzt wie im erstgenannten Fall, so kann der Mpemba-Effekt zwar eintreten und schneller Eis produzieren, jedoch in geringerer Menge. Aber selbst in diesem Fall wäre es absolut gesehen schneller gewesen, eine verminderte Ausgangsmenge Wasser direkt und ohne Umwege abzukühlen.
Aus diesen genannten Gründen ist eine sinnvolle technische Nutzung des Mpemba-Effekts ausgeschlossen, da es für jedes Kristallisationsproblem immer eine energiesparendere und schnellere Lösung gibt.
Nutzung durch Mpemba
Diese Tatsache schließt natürlich nicht aus, dass es in der Praxis Anwendungen gibt, in denen der Mpemba-Effekt auftritt. Mpemba selbst hat eine solche entdeckt, indem er sein Eis schneller gefrieren lassen konnte. Jedoch stellt der Effekt in solchen Fällen eine (thermodynamisch betrachtet) unerwünschte Nebenwirkung dar. Diese bestand in Mpembas Fall darin, dass er weniger Speiseeis produziert hat, als unter optimalen Bedingungen möglich gewesen wäre. Außerdem musste er den Kühlschrank öfter enteisen.
Fazit
Der Mpemba-Effekt ist im Ergebnis ein überraschender und der Intuition widersprechender Schaueffekt, dessen physikalisch-chemische Grundlage im Wesentlichen in der seit dem 19. Jahrhundert bekannten Augustschen Formel zu sehen ist.
Mpembas Verdienst ist es, den Effekt wiederentdeckt und einem breiteren naturwissenschaftlich interessierten Publikum bekannt gemacht zu haben.
Die Betrachtung des Effekts ist dazu geeignet, die Kenntnisse der Prinzipien der klassischen Thermodynamik anhand eines ebenso anschaulichen wie verblüffenden Experiments der realen Welt zu schulen und zu vertiefen.
Erwähnung in Radio und Fernsehen
Am 21. Januar 2010 berichtete der WDR in Die Kleine Anfrage im Rahmen der Radiosendung Leonardo über den Mpemba-Effekt, wobei einige O-Töne von Mpemba eingespielt wurden[1].
In der Sat.1-Fernsehsendung Clever! – Die Show, die Wissen schafft vom 13. März 2006 (Sendung 39) wurde der Mpemba-Effekt durch Abkühlung von unterschiedlichen, nicht bestimmten Ausgangsmengen Wasser unterschiedlicher, nicht bestimmter Zusammensetzung (Mineralwasser, destilliertes Wasser, Leitungswasser) und unterschiedlicher Temperatur in einem offenen System demonstriert. Wie zu sehen war, erfolgten Versuchsaufbau und -durchführung damit unter weitgehend undefinierten Ausgangs- und Endbedingungen. Die in der Sendung angegebene und unter dem untenstehenden Link (s. Weblinks) zu findende Erläuterung des Effektes ist unzutreffend.
Bereits am 28. März 1999 hat die ARD-Wissenschaftssendung Kopfball den Mpemba-Effekt nachvollziehbar demonstriert und erklärt.
Literatur
Zwei Artikel desselben Autors in englischer Sprache mit zahlreichen Quellenangaben, auch zu den historischen Autoren wie Aristoteles, Bacon, Descartes:
- Can hot water freeze faster than cold water? von M. Jeng
- Monwhea Jeng: The Mpemba effect: When can hot water freeze faster than cold?. In: American Journal of Physics. Vol. 74, Nr. 6, S. 514-522, arXiv:physics/0512262, doi:10.1119/1.2186331.
- James D. Brownridge: A search for the Mpemba effect: When hot water freezes faster then cold water. 16. März 2010, arXiv:1003.3185.
Weblinks
- www.wissenschaft-technik-ethik.de - Der Mpemba Effekt
- Der Mpemba-Effekt bei Clever - Die Show, die Wissen schafft
- www.wissenschaft.de: Warum heißes Wasser schneller zu Eis wird als kaltes
Einzelnachweise
Wikimedia Foundation.