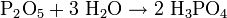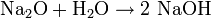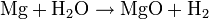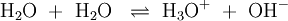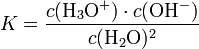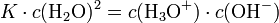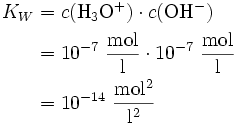- Diwasserstoffoxid
-
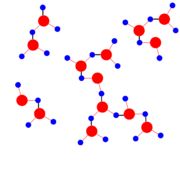
Kalottenmodell des Wassermoleküls 
Allgemeines Name Wasser Andere Namen Dihydrogenmonoxid, μ-Oxidodiwasserstoff, Diwasserstoffoxid, Oxidan Summenformel H2O CAS-Nummer 7732-18-5 Kurzbeschreibung transparente und nahezu farblose Flüssigkeit, zudem geschmacks- und geruchlos, wenn Reinstoff zentrale Stoffdaten Molmasse 18,0153 g/mol Dichte 3,98 °C: 0,999975 g·cm−3
20 °C: 0,998203 g·cm−3Schmelzpunkt 0,00 °C Siedepunkt 99,97 °C Tripelpunkt 0,01 °C / 6,1166 hPa kritischer Punkt 374,15 °C / 22,12 MPa Sättigungsdampfdruck 31,6874 hPa (25 °C) spezifische Wärmekapazität 4187 J/(kg·K) Wärmeleitfähigkeit 0,597 W/m·K (20 °C) Verdampfungswärme 2257 kJ/kg bzw. 40,8 kJ/mol Schmelzwärme 332,5 kJ/kg Brechzahl 1,33251 (25 °C, sichtbares Licht) / 1,310 (Eis) Viskosität 1,0 mPa s (20 °C) Dielektrizitätskonstante 80,35 (20 °C) Löslichkeit Gut in polaren, schlecht in unpolaren Lösungsmitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die Eigenschaften des Wassers verleihen ihm seine grundlegende Bedeutung für das Leben auf der Erde. Diese physikalischen, chemischen, elektrischen und optischen Eigenschaften beruhen auf dem Aufbau des Wassermoleküls und den daraus resultierenden Verkettungen und Wechselwirkungen der Wassermoleküle untereinander über Wasserstoffbrückenbindungen, elektrische Dipolkräfte und weitere Kräfte wie Van-der-Waals-Kräfte.
In der Natur kommt Wasser als Reinstoff, also ohne gelöste Stoffe, nicht vor, es finden sich praktisch immer Verunreinigungen, wenn auch möglicherweise in kaum messbarer Konzentration. Sehr reines Wasser wird im Labor meistens durch Destillation hergestellt und wird daher destilliertes Wasser genannt. Durch das Lösen treten Veränderungen in den Eigenschaften des Wassers auf.
Physikalische Eigenschaften
Die physikalischen Eigenschaften des Wassers sind stark von der Temperatur und dem Druck abhängig. Vollkommen reines Wasser besitzt eine molare Masse von 18,0153 g/mol und bei 3,98 °C unter Normaldruck seine höchste Dichte von 0,999975 kg/dm³ (siehe Dichte und Dichteanomalie). In der Zeit von 1901 bis 1964 war die Definition des Liters an das Volumen von 1 kg Wasser bei der Temperatur seiner höchsten Dichte unter Normaldruck gebunden.
Die Oberflächenspannung und die Viskosität des Wassers nehmen mit zunehmender Temperatur ab. Ebenso ist die Kompressibilität temperaturabhängig.
Die Eigenschaften des Wassers sind besonders von der dreidimensionalen Verkettung der Wassermoleküle über Wasserstoffbrückenbindungen bestimmt. Ohne diese hätte eine Substanz mit einer so geringen molaren Masse wie Wasser ganz andere Eigenschaften. Dieses gilt besonders für den hohen Schmelz- und Siedepunkt sowie für die Dichteanomalie.
Aggregatzustände
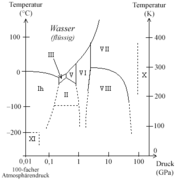
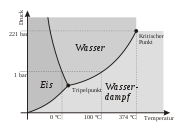
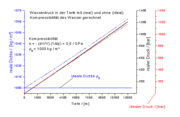
Unter Normalbedingungen ist Wasser, wie im obigen Phasendiagramm erkennbar, eine Flüssigkeit. Es ist der einzige bekannte Stoff, der in der Natur in nennenswerten Mengen in allen drei klassischen Aggregatzuständen existiert. Das Phasendiagramm zeigt dabei, in wieweit der Aggregatzustand des Wassers von Temperatur und Druck abhängt. Der kritische Punkt des Wassers liegt bei 374,15 °C und 2,21 · 107 Pa, der Tripelpunkt bei 0,01 °C und 611,657 ± 0,010 Pa.
Für die Eigenschaften und Besonderheiten des gasförmigen und festen Aggregatzustands des Wassers siehe die Artikel Wasserdampf und Eis.
Schmelz- und Siedepunkt
Im Vergleich zu chemisch ähnlichen Verbindungen wie Schwefelwasserstoff (-61 °C), Selenwasserstoff (-41 °C) oder Tellurwasserstoff (-2 °C) hat Wasser einen relativ hohen Siedepunkt. Die obige Zunahme liegt an der ebenfalls zunehmenden molaren Masse und der dadurch höheren Energiemenge, die notwendig ist, um den jeweiligen Stoff in den gasförmigen Aggregatzustand zu überführen. Methan hat beispielsweise eine dem Wasser recht ähnliche molare Masse und siedet unter Normaldruck bei -164 °C. Nimmt man die molare Masse des Wassers als alleiniges Merkmal, so müsste es demnach einen Siedepunkt von -80 °C besitzen. Dieser liegt jedoch bei 100 °C, also um volle 180 K höher. Falls Wasser den aus der molaren Masse abgeleitenden Regeln entspräche, so müsste es folglich bei Raumtemperatur als Gas und nicht als Flüssigkeit vorliegen.
Das gleiche Bild zeigt sich auch beim Schmelzpunkt; er beträgt -86 °C bei Schwefelwasserstoff, -66 °C bei Selenwasserstoff und -49 °C bei Tellurwasserstoff. Bei Wasser müsste er nach der molaren Masse bei etwa -100 °C liegen, tatsächlich liegt er aber bei 0 °C. Vergleicht man den Bereich, in dem Wasser als Flüssigkeit vorkommt, so ergibt sich eine Spanne von 20 K für den Fall, dass man allein die molare Masse betrachtet. In der Realität ist diese Spanne mit 100 K jedoch erheblich größer.
All diese Besonderheiten ergeben sich durch den Aufbau des Wassermoleküls und dessen Neigung, über Wasserstoffbrückenbindungen vernetzte Cluster wie im Bild rechts zu bilden. Diese zusätzlichen Bindungen, die bei den anderen Stoffen nicht vorkommen, müssen bei jedem Phasenübergang zusätzlich überwunden bzw. berücksichtigt werden.
Wasser siedet also unter Normalbedingungen bei 100 °C und Eis schmilzt bei 0 °C. Wasser erstarrt demnach bei 0 °C; es kann allerdings auch bei Normalbedingungen unter 0 °C noch als Flüssigkeit vorliegen. Es handelt sich dann um unterkühltes Wasser. Der Siedepunkt des Wassers ist allerdings stark vom Sättigungsdampfdruck abhängig. Die Siedetemperatur sinkt bei Annäherung an den Tripelpunkt zusammen mit dem Siededruck und beide erreichen an diesem Punkt ihr Minimum. Wasser lässt sich zudem aber auch etwas über seinen Siedepunkt hinaus erhitzen, was man als Siedeverzug bezeichnet.
Auch im Wasser gelöste Stoffe verändern Siede- und Schmelzpunkt. So weist Wasser eine molare Schmelzpunkterniedrigung von 1,853 K·kg/mol und eine molare Siedepunkterhöhung von 0,513 K·kg/mol auf.
Siehe auch: Stoffwerte des Sättigungsdampfdrucks in Abhängigkeit von Siede- und Sublimationstemperatur
Früher wurde die Celsius-Temperaturskala über Schmelz- und Siedepunkt von Wasser definiert. Durch die aktuelle Definition der Celsius-Skala über die Kelvin-Skala sind Schmelz- und Siedepunkt von Wasser nicht mehr genau 0°C und 100°C, sondern liegen bei 0,002519°C und 99.9839°C (99.9743°C nach ITS-90). [1]
Eine Besonderheit beim Erstarren von Wasser ist der, nach seinem Entdecker benannte, Mpemba-Effekt, wonach heißes Wasser unter speziellen Bedingungen schneller gefriert als kaltes.
Erhitzen von Wasser
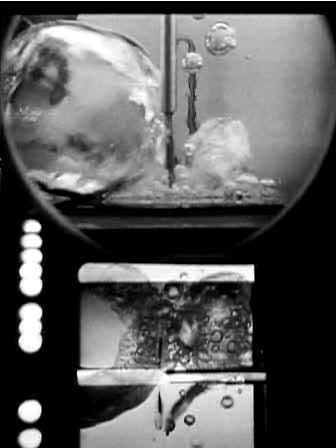
Wird Wasser in einem Topf auf einer Herdplatte erhitzt, erwärmt sich das Wasser am Boden schneller als das an der Oberfläche. So bildet sich ein labiler Temperaturgradient aus, der jedoch bald weitgehend durch Konvektion verschwindet. Erreicht das Wasser am Boden die Siedetemperatur, bilden sich dort Wasserdampfblasen. Beim Aufsteigen kühlen sie sich wieder ab und fallen zusammen. Sie erzeugen das typische prasselnde Geräusch, das kurz vor dem Sieden zu hören ist. Bei weiterer Wärmezufuhr kollabieren nur noch die kleinen Blasen, die großen steigen auf. Das Siedegeräusch wird leiser, um beim kompletten Sieden des Wassers ganz zu verschwinden.
Unter Schwerelosigkeit steigen die Dampfblasen im Wasser nicht auf. Statt dessen verharren sie in der Nähe des Topfbodens und konglomerieren zu größeren Blasen und schließlich zu einer einzigen großen Blase. Die fehlende Konvektion und die verringerte Wärmeleitung durch die Dampfblasen erschweren das schnelle Kochen von Wasser in einem Raumschiff.
Sublimation und Resublimation
Im Temperaturbereich von etwa 0 bis 273,16 K (-273,15 bis 0,01 °C) und einem Druckbereich von Vakuum bis ungefähr 0,006 bar, also im Bereich unterhalb des Tripelpunktes, existiert Wasser nicht in flüssiger Form, sondern nur gasförmig und fest. Eis geht in diesem Bereich, also am Sublimationspunkt, direkt in den gasförmigen Zustand über, ohne dass eine Aggregatzustandsänderung in eine Flüssigkeit stattfindet. Dieser Vorgang wird als Sublimation bzw. in Gegenrichtung als Resublimation bezeichnet. Im Vakuum findet die Sublimation bis fast 0 Kelvin (-273,15 °C) statt. Die Obergrenze ist hingegen durch den Tripelpunkt gegeben.
Spezifische Wärmekapazität
Flüssiges Wasser hat eine sehr hohe spezifische Wärmekapazität von 4187 J/(kg·K), man braucht also für die Erhitzung eines Kilogramms um ein Kelvin 4,2 Kilojoule an thermischer Energie. Das bedeutet, dass Wasser im Vergleich mit anderen Flüssigkeiten recht viel Energie aufnehmen kann, ohne dass sich die Temperatur dabei deutlich erhöhen würde. Dadurch wird auch beim Abkühlen ebenso viel Energie wieder frei.
Wasserdampf hat eine spezifische Wärmekapazität von 1870 J/(kg·K) und Eis 2060 J/(kg·K). Feste Stoffe haben in der Regel eine deutlich niedrigere spezifische Wärmekapazität. So hat etwa Blei eine Wärmekapazität von 129 J/(kg·K), Kupfer eine von 380 J/(kg·K).
Siehe auch: Stoffdaten zur spezifischen Wärmekapazität des Wassers
Schmelz- und Verdampfungswärme
Für die Wandlung von 0 °C kaltem Eis in 0 °C kaltes Wasser muss eine Energie von 332,5 kJ/kg aufgebracht werden. Zur Umwandlung von 100 °C warmen Wasser in 100 °C warmen Dampf werden 2.257 kJ/kg benötigt. Um 0 °C kaltes Wasser in 100 °C warmen Dampf zu ändern, benötigt man 100 K · 4,19 kJ/kgK + 2.257 kJ/kg = 2.676 kJ/kg. Die Verdampfungswärme des Wassers liegt wesentlich höher als die Verdampfungswärme von anderen Flüssigkeiten, Methanol hat im Vergleich nur eine Verdampfungswärme von 845 kJ/kg und Quecksilber sogar nur eine von 285 kJ/kg.
In der Meteorologie kommen der Schmelz- und Verdampfungswärme im Rahmen der latenten Wärme eine große Bedeutung zu.
Wärmeleitfähigkeit
Wasser hat im Vergleich zu anderen Flüssigkeiten eine hohe Wärmeleitfähigkeit, aber im Vergleich mit einigen Metallen eine sehr geringe. Die Wärmeleitfähigkeit des Wassers nimmt mit steigender Temperatur zu, Eis leitet Wärme jedoch wesentlich besser als flüssiges Wasser.
Bei 20 °C weist Wasser eine Wärmeleitfähigkeit 0,60 W/mK auf. Zum Vergleich: Kupfer 394 W/mK und Silber 429 W/mK.
Siehe auch: Stoffdaten zur Wärmeleitfähigkeit des Wassers
Dichte und Dichteanomalie
Wasser hat unter Normaldruck seine größte Dichte von 1000 Kilogramm pro Kubikmeter bei 3,98 °C und zeigt damit eine Dichteanomalie. Diese besteht darin, dass sich Wasser unterhalb von 3,98 °C bei weiterer Temperaturverringerung, auch beim Wechsel zum festen Aggregatzustand, wieder ausdehnt, was man nur von wenigen Stoffen kennt. Die derzeit genauesten publizierten Werte für die maximale Dichte liegen bei (999,974950 ± 0,00084) kg/m³ und bei (3,983 ± 0,00067) °C für die Temperatur, bei der dieser Wert erreicht wird. Die Werte stellen einen Mittelwert der von verschiedenen physikalischen Instituten veröffentlichten Zahlen dar (Stand 2001).
Die Berechnung der Dichte von luftfreiem Wasser DLF in Abhängigkeit von der Temperatur T ([T] = °C) kann mit Hilfe der folgenden Virialgleichung erfolgen:
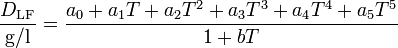 .
.
mit den Koeffizienten: a0 = 999,83952; a1 = 16,952577 (°C)-1; a2 = -7,9905127·10-3 (°C)-2; a3 = -4,6241757·10-5 (°C)-3; a4 = 1,0584601·10-7 (°C)-4; a5 = -2,8103006·10-10 (°C)-5 und b = 0,0168872. Für die Berechnung der Dichte von luftgesättigtem Wasser korrigiert man den Wert nach DLG/(g/l) = DLF/(g/l) - 0,004612 + 0,000106 (°C)-1·T. (Quelle: PTB-Mitteilungen 100/3-90)
Im festen Aggregatzustand – in diesem Fall bei Eis – wird normalerweise eine hohe Fernordnung durch Ausbildung eines Kristallgitters im Zuge der Kristallisation erreicht. Im flüssigen Zustand herrscht eine Mischung von Ordnung und Chaos, wobei die Moleküle aufgrund ihrer höheren Geschwindigkeit ein größeres Volumen ausfüllen. Es erhöht sich also das Volumen und die Dichte wird damit geringer. Im gasförmigen Zustand ist die maximale Unordnung erreicht und die Atome verteilen sich dementsprechend gleichmäßig über den maximal zur Verfügung stehenden Raum.
Der Grund der Anomalie des Wassers ist die Verkettung der Wassermoleküle über Wasserstoffbrückenbindungen. Durch sie benötigt die Struktur des festen Zustands mehr Platz als die Struktur bei beweglichen Molekülen. Die Strukturbildung ist ein fortschreitender Vorgang, das heißt, dass schon im flüssigen Zustand so genannte Cluster aus Wassermolekülen vorhanden sind. Bei 3,98 °C ist der Zustand erreicht, bei dem die einzelnen Cluster das geringste Volumen einnehmen und damit die größte Dichte haben. Wenn die Temperatur weiter sinkt, wird durch einen stetigen Wandel der Kristallstrukturen mehr Volumen benötigt. Wenn die Temperatur steigt, benötigen die Moleküle wieder mehr Bewegungsfreiraum und das Volumen steigt ebenfalls.
Die sprunghafte Volumenzunahme des Wassers um etwa 9 % beim Gefrieren (im Diagramm entsprechend eine Abnahme der Dichte) und die dabei auftretenden großen Kräfte bewirken ein Bersten von Rohren, Mauerwerken, Straßenbelägen und Aufschüttungen, was man als Frostsprengung bezeichnet. Zur Vorsorge werden die Gartenleitungen im Winter entleert, Mauerwerke gestrichen und Aufschüttungen so angelegt, dass das Wasser abfließen kann. Bauwerke werden so angelegt, dass sich Wasser unter ihnen entweder nicht ansammeln oder nicht gefrieren kann, was man bei größeren Flächen und insbesondere Straßen durch ein Kies- oder Schotterbett erreicht (Frostschutz).
Neben der Temperatur beeinflussen auch im Wasser gelöste Stoffe dessen Dichte, was man mit einem Aräometer messen kann. Da sich die gelösten Teilchen zwischen den Wassermolekülen verteilen und die Volumenzunahme gering ist, steigt dadurch die Dichte an. Die Zunahme der Dichte entspricht dabei in etwa der Masse an gelöstem Stoff pro Volumen und spielt eine wichtige Rolle für großräumige Wasserbewegungen, zum Beispiel im Rahmen der thermohalinen Zirkulation oder der Dynamik von Süßwasserlinsen.
Die Dichteanomalie verhindert, dass Gewässer im Winter von unten her zufrieren. Die dichtesten Wasserschichten sinken nach unten und ermöglichen es so Wassertieren und -pflanzen, in Grundnähe zu überleben. Das oben schwimmende Eis dämmt gleichzeitig nach unten und verringert so die weitere Auskühlung (und damit die weitere Eisbildung) in tieferen Gewässerschichten. vgl. Thermische Schichten
Geruch, Farbe und Geschmack
Wasser ist im reinen Zustand geschmack- und geruchlos. Da es Licht verstärkt im roten sichtbaren und im nahen Infrarotbereich absorbiert, erscheint Wasser blau, was allerdings erst in dickeren Schichten ab einigen Metern auch mit dem bloßen Auge wahrnehmbar ist (siehe Lambert-Beersches Gesetz). Bei im Wasser gelösten Stoffen kann es zu einer deutlichen Veränderung dieser Eigenschaften kommen, was durch den spektralen Absorptionsgrad beschrieben wird. Färbung und Trübung des Wassers in Abhängigkeit von den ihm enthaltenen Substanzen spielen eine wichtige Rolle als Indikatoren für die Wasserqualität sowie auch als Untersuchungsmethode in der Wasseranalytik.
Optische Eigenschaften
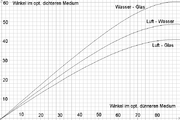
Tritt Licht aus der Luft ins Wasser ein, so wird es gebrochen. Dieser Effekt ist mit einer Brechzahl von durchschnittlich 1,33 für sichtbares Licht schwächer als beispielsweise beim Übergang von Luft in die meisten Glassorten oder gar in Diamant, aber stärker als beispielsweise bei Methanol.
Das Reflexionsvermögen der Oberfläche Wasser-Luft beträgt bei exakt senkrechtem Einfall 0 % und nimmt mit flacherem Einfallswinkel bis gegen 100 % zu. Beim Auftreffen von Licht aus der Luft auf die Wasseroberfläche kommt es also zu einer vom Einfallswinkel abhängigen Aufspaltung in einen Anteil, der in das Wasser eintritt und dabei gebrochen wird, und einen anderen Anteil, der reflektiert wird. Dabei tritt auch eine Aufspaltung in unterschiedlich polarisierte Lichtanteile auf: das eintretende Licht ist bevorzugt in der Ebene polarisiert, die das Lot mit dem Lichtstrahl bildet ("Einfallsebene"), das reflektierte Licht ist senkrecht dazu polarisiert (bei Sonne auf Gewässern also im geografischen Sinn horizontal). Der Polarisationseffekt wird umso stärker, je flacher das Licht auf die Wasseroberfläche trifft.
Trifft Licht vom Wasser her auf die Wasser-Luft-Grenzfläche, so kommt es, als direkte Folge des Brechungsgesetzes, ab einem Grenzwinkel von 49° zu einer Totalreflexion. Das bedeutet, dass flacher auf die Grenzfläche treffende Lichtstrahlen nicht aus dem Wasser austreten sondern reflektiert werden.
Die Lichtbrechung führt zu optischen Täuschungen, so dass man ein Objekt unter Wasser an einem anderen Ort sieht, als an dem es tatsächlich ist. Das gleiche gilt für einen Blick aus dem Wasser in den Luftraum. Tiere, die, wie Fischreiher, auf den Fischfang spezialisiert sind, oder Fische, die nach Insekten über dem Wasser jagen, können diese Bild-Versetzung berücksichtigen und treffen ihre Beute deshalb meistens problemlos.
Die große Lichtdurchlässigkeit des Wassers ermöglicht die Existenz von Algen und Pflanzen im Wasser, die Licht zum Leben benötigen. Langwelliges (rotes) Licht wird stärker absorbiert als kurzwelliges (blaues) Licht.
Einige optische Effekte in der Atmosphäre sind an die Brechungseigenschaften des Wassers geknüpft. So wird zum Beispiel ein Regenbogen durch Wassertröpfchen oder ein Halophänomen durch Eiskristalle hervorgerufen, in denen das Licht gebrochen und dabei nach Spektralfarben aufgespalten wird. Auch die Abdunklung der Erde durch Wolken geht auf die Lichtbrechung und Totalreflexionen an und in den Wassertröpfchen zurück, die dadurch einen Teil des Lichts von der Erde weg ablenken.
Spezifischer Widerstand und elektrische Leitfähigkeit
Chemisch reines Wasser ist bei einem pH-Wert von 7 nur in geringem Umfang in die elektrischen Ladungsträger H3O+ und OH- dissoziiert. Es besitzt daher einen hohen spezifischen Widerstand von 18,2 MΩcm. Dieses entspricht einen spezifischen Leitwert von 0,0549 µScm-1 (bei 25 °C). Die Temperaturabhängigkeit beträgt dabei ungefähr 1,5 bis 2 % pro Kelvin. Gelöste Salze und Säuren erhöhen die Ladungsträgerkonzentration. Bereits Leitungswasser erreicht je nach Mineralgehalt bis etwa die 10000-fache Leitfähigkeit von durchschnittlich 500 µScm-1, Meerwasser erreicht Werte von 50 mScm-1.
Beim Löschen von Bränden kann es vorkommen, dass durch das Löschwasser zwischen stromführenden Teilen (Kabel, Elektrogeräte) eine leitfähige Verbindung bis hin zum sogenannten Kurzschluss entsteht oder dass die löschende Person selbst über das Wasser Teil eines Stromkreises wird und einen elektrischen Schlag erhält.
Viskosität
Die Viskosität (Zähigkeit) des Wassers bei 20 °C beträgt 1,0 mPa s. Es hat damit eine höhere Viskosität als Petroleum (0,65 mPa s bei 20 °C), aber auch eine niedrigere als zum Beispiel Quecksilber (1,5 mPa s bei 20 °C). Die Viskosität des Wassers nimmt durch die abnehmende Zahl von Wasserstoffbrückenbindungen mit zunehmender Temperatur ab und erreicht am Siedepunkt 0,283 mPa s.
Die Viskosität wird durch gelöste Stoffe verändert. Neben der Konzentration ist die Art des gelösten Stoffes ausschlaggebend für die Viskosität der Lösung.
Siehe auch: Stoffdaten zur Viskosität des Wassers
Oberflächenspannung
Wasser weist eine vergleichsweise große Oberflächenspannung auf, da sich die Wassermoleküle gegenseitig relativ stark anziehen. Die Oberflächenspannung beträgt etwa 73 mN/m bei 20 °C und nimmt bei zunehmender Temperatur ab. Wegen der großen Oberflächenspannung können beispielsweise Wasserläufer sich auf dem Wasser bewegen. Bei Waschvorgängen ist Oberflächenspannung hinderlich, weshalb in Waschmitteln grenzflächenaktive Stoffe (Tenside) enthalten sind, die die Oberflächenspannung senken. Deren Vorkommen ist in natürlichen Gewässern jedoch gering.
Siehe auch: Stoffdaten zur Oberflächenspannung des Wassers
Benetzbarkeit
Bei einer glatten Oberfläche können Kontaktwinkel von maximal 120° erreicht werden. Bei aufgerauten Oberflächen mit hydrophobem Charakter kann dieser Winkel jedoch auch bis zu 160° betragen, was man als Superhydrophobie bezeichnet. Dieses machen sich viele Pflanzen über den Lotuseffekt zu nutze.
Kompressionsmodul und Schallgeschwindigkeit
Wasser hat bei einer Temperatur von 4 °C unter Normaldruck ein Kompressionsmodul von ungefähr 2,06 GPa – bei 100 MPa (tausendfacher Normaldruck bzw. Wasserdruck in knapp 10 km Tiefe) wird es daher um etwa 5 Prozent zusammengedrückt. Entsprechend der Dichte von 1 kg/dm³ ergibt sich hieraus eine Ausbreitungsgeschwindigkeit von Schall in Wasser von 1435 m/s.
Isotopenfraktionierung
Wassermoleküle bestehen aus verschiedenen Isotopen des Sauerstoffs und Wasserstoffs, die jeweils in unterschiedlichen Konzentrationen vorkommen. Bei bestimmten Vorgängen wie der Niederschlagsbildung und deren Phasenübergängen kommt es dabei zur Isotopenfraktionierung, das heißt das Wasser verändert hierbei seine Isotopenzusammensetzung. Je nach Umgebungsbedingungen und der ursprünglichen Zusammensetzung ergeben sich hieraus spezifische Isotopensignale, die als eine Art Fingerabdruck für unterschiedliche Prozesse und Herkunftsgebiete fungieren können. Anwendung findet die entsprechende Methodik vor allem in der Hydrogeologie und Paläoklimatologie.
Wasser als Lösungsmittel
Wasser ist durch seinen Dipol ein hervorragendes polares Lösungsmittel für viele Stoffe. Generell gilt, dass die Wasserlöslichkeit mit steigender Polarität des Stoffes zunimmt. Wasser besitzt eine vergleichsweise hohe Dielektrizitätskonstante von 80,35 (bei 20 °C).
Die Löslichkeit in Wasser ist oft stark von der Temperatur abhängig. Dabei verhalten sich Feststoffe und Gase unterschiedlich. Gase lösen sich proportional zum Partialdruck des Gases in Wasser ohne eine feste Begrenzung der lösbaren Menge (Henry-Gesetz). Die hierbei als „Löslichkeit“ bezeichnete Gleichgewichtskonzentration je Druckeinheit nimmt mit zunehmender Temperatur ab. Dagegen lösen sich Feststoffe bei zunehmender Temperatur meistens besser in Wasser, wovon es aber auch viele Ausnahmen gibt, wie zum Beispiel Lithiumsulfat.
Manche Substanzen wie zum Beispiel Aceton oder Ethanol sind in beliebigem Verhältnis mit Wasser mischbar, also in einander löslich. In anderen Fällen gibt es wechselseitige Lösungen mit einer Mischungslücke, zum Beispiel mit Phenol oder Chloroform.
Normalerweise gilt, dass ein molekularer Stoff sich umso besser in Wasser löst, je mehr polare Gruppen in diesem Stoff vorhanden sind. Überkritisches Wasser zeigt jedoch ähnliche Löslichkeitseigenschaften wie unpolare organische Lösungsmittel.
Beim Auflösen von ionischen Stoffen im Wasser laufen der endotherme Gitterabbau und die exotherme Hydration ab, was Wärmemischungen (Schwefelsäure in Wasser) und Kältemischungen (Salze in Wasser) ermöglicht. Dabei entscheidet die Differenz zwischen der exothermen Hydration und dem endothermen Gitterabbau, ob eine Erwärmung oder eine Abkühlung eintritt. Bei Salzen entscheidet das Verhältnis zwischen Gitterenergie und Hydratationsenergie der beteiligten Ionen über die Löslichkeit, die hier definiert ist als das Produkt der molaren Ionenkonzentrationen bei Gleichgewicht mit der kristallinen Substanz (Löslichkeitsprodukt). Als Faustregel für die Löslichkeit von Ionenverbindungen kann gelten: Je höher die Ladungszahl der beteiligten Ionen, desto schwerer löslich ist der Stoff in Wasser.
Im Unterschied zu einfachen Verbindungen wie Natriumchlorid, werden die Ionenbindungen von Komplexen nicht gespalten. Dabei unterscheidet man zwischen zwei Gruppen. Auf der einen Seite den starken Komplexen, wie die Cyanid-Komplexe der Schwermetalle, und auf der anderen Seite die schwachen Komplexe (Aquakomplexe) der Metallionen mit Sulfat-, Hydroxil- oder Carbonationen. Die Art und das Vorkommen der verschiedenen Metallspezies sind wichtige Fragestellungen der chemischen Wasseranalytik und Wasseraufbereitung.
Bei Molekülen mit unterschiedlicher Polarität, wie zum Beispiel vielen amphiphilen Lipiden, richtet sich die Wasserlöslichtkeit bzw. Wasseraffinität nach dessen Ausrichtung. Diesen Effekt machen sich fast alle Lebewesen mit ihren Biomembranen zunutze. Man spricht in diesem Kontext auch von einer Hydrophilie oder Hydrophobie.
Chemische Eigenschaften
Wasser hat eine molare Masse von 18,01528 g·mol−1. Wasser ist bei vielen Reaktionen ein Katalysator, das heißt, ohne die Anwesenheit von Wasser würde eine Reaktion wesentlich langsamer und mit höherer Aktivierungsbarriere ablaufen. Viele Reaktionen werden sogar durch die normale Luftfeuchtigkeit ermöglicht oder beschleunigt. Das fällt durch die eigentlich immer vorhandenen Spuren von Feuchtigkeit in unserer Umwelt praktisch nicht auf, da es den Normalfall darstellt. Erst wenn durch spezielle Trocknungsverfahren auch geringste Reste von Feuchtigkeit entfernt und die chemischen Versuche in geschlossenen Systemen durchgeführt werden, ist das nachzuweisen. So brennt in dieser Umgebung zum Beispiel Kohlenmonoxid nicht in Sauerstoff und Alkalimetalle reagieren nicht mit Schwefelsäure und Chlor.
Reaktivität
Wasser ist amphoter, ist also ein Stoff, der - je nach Milieu - sowohl als Säure als auch als Base wirken kann.
Wasser reagiert mit Anhydriden zu Säuren oder Basen. Beispiele:
- Phosphorpentoxid (Säureanhydrid) reagiert mit Wasser zu Phosphorsäure (Säure):
- Natriumoxid (Basenanhydrid) reagiert mit Wasser zu Natriumhydroxid (Base):
Wasser reagiert mit unedlen Metallen unter Wasserstoffbildung zu Metalloxiden, diese Metalloxide sind aber Basenahydride und lösen sich meistens gleich wieder in Wasser zu Basen, wie eben beschrieben wurde. Ein Beispiel:
- Magnesium reagiert mit Wasserdampf zu Magnesiumoxid und Wasserstoff:
Die wohl wichtigste Reaktion des Wassers ist die Photosynthese, die für Pflanzen und andere Lebewesen lebensnotwendig ist. Sie liefert die für Pflanzen wichtige Stärke und für den Menschen Sauerstoff.
Nivellierender Effekt
In wässrigen Lösungen dissoziieren starke Säuren und starke Basen vollständig zu H3O + - bzw. OH - -Ionen. So lassen sich die unterschiedlichen Säurestärken von z. B. Chlorwasserstoff und Perchlorsäure in Wasser nicht mehr anhand des pH-Wertes unterscheiden. Hier spricht man vom nivellierenden Effekt (v. frz.: niveler = gleichmachen) des Wassers. Um auch sehr starke Säuren bezüglich der Säurestärke unterscheiden zu können, bestimmt man Gleichgewichtskonstanten in nichtwässrigen Lösungen und überträgt diese annäherungsweise auf das Lösungsmittel Wasser.
pH-Wert
Destilliertes Wasser hat einen pH-Wert von 7, ist also neutral. In der Natur hat Wasser aber einen pH-Wert zwischen 5 und 7, da reines Wasser ohne gelöste Stoffe dort nicht vorkommt. Lässt man Wasser an der Luft stehen, lösen sich Gase im Wasser, die den pH-Wert beeinflussen. So bildet beispielsweise CO2 aus der Luft mit Wasser Kohlensäure und senkt so den pH-Wert.
Ionenprodukt
Das Ionenprodukt des Wassers ist das Produkt der Konzentrationen der H3O+ und OH--Ionen im Wasser. Bei einer Leitfähigkeitsmessung von destilliertem Wasser tritt ein geringer Stromfluss auf. Dieses ist ein Hinweis auf Ionen im Wasser, die nur durch die Autoprotolyse des Wassers entstanden sein können, gemäß folgender Reaktion:
Durch Aufstellen des Massenwirkungsgesetzes ergibt sich:
Da die Konzentration von Wasser fast konstant ist (55,5 mol/l), kann diese in die Konstante einbezogen werden:
Kw ist demzufolge das Produkt aus Oxonium- und Hydroxidionen:
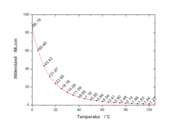
Bei 25 °C gilt Kw=10-14 (mol/l)². Damit liegt das Gleichgewicht sehr stark auf der Seite des Wassers. Die Konzentrationen von H3O+ und OH--Ionen betragen jeweils 10 − 7 mol/L. Der pH-Wert ist also 7. Wird die Konzentration einer der beiden Ionen erhöht, bleibt das Ionenprodukt von 10 − 14 erhalten, d. h. die Konzentration des anderen Ions sinkt. Für die pH- und pOH-Werte gilt deshalb immer, dass ihre Summe 14 ergibt.
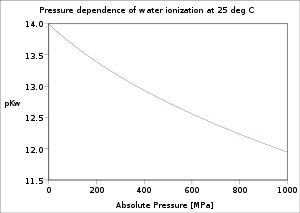
Der pKW des Wassers ändert sich in Abhängigkeit von der Temperatur.
T in °C 0 20 25 40 80
pKW
14,9 14,2 14 13,5 12,6
c(H3O+) in mol/l
10-7,45 10-7,1 10-7 10-6,75 10-6,3 (experimentelle Werte bestimmt durch Leitfähigkeitsmessung)
Literatur
- Klaus Scheffler (1981): Wasserdampftafeln: thermodynam. Eigenschaften von Wasser u. Wasserdampf bis 800°C u. 800 bar, Berlin [u. a.] ISBN 3-540-10930-7
- Leopold Lukschanderl (1991): Wasser: der Stoff, der zwar gewöhnlich aussieht, aber ganz außergewöhnliche Eigenschaften besitzt. Wien. ISBN 3-851-28062-8
- L.A. Guildner, D.P. Johnson und F.E. Jones (1976): Vapor pressure of Water at Its Triple Point. J. Res. NBS - A, Vol. 80A, No. 3, p. 505 - 521
Weblinks
Wikimedia Foundation.