- Bromwasserstoff
-
Strukturformel 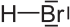
Allgemeines Name Bromwasserstoff Andere Namen - Hydrogenbromid
- Broman
Summenformel HBr CAS-Nummer 10035-10-6 Kurzbeschreibung farbloses, an feuchter Luft rauchendes Gas mit stechendem Geruch[1]
Eigenschaften Molare Masse 80,91 g·mol−1 Aggregatzustand gasförmig
Dichte Schmelzpunkt Siedepunkt −66,72 °C [2]
Dampfdruck pKs-Wert −9 [3]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 


Gefahr
H- und P-Sätze H: 331-314-280-335 EUH: keine EUH-Sätze P: 260-280-304+340-303+361+353-305+351+338-405-403 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 
Ätzend (C) R- und S-Sätze R: 35-37 S: (1/2)-7/9-26-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bromwasserstoff ist ein farbloses Gas, welches an feuchter Luft Nebel bildet, weil sich die Verbindung aus Brom und Wasserstoff gut in Wasser unter Bildung von Bromwasserstoffsäure löst.
Inhaltsverzeichnis
Darstellung
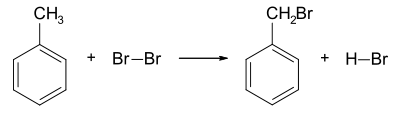
Bromwasserstoff kann mit Hilfe einer Substitutionsreaktion dargestellt werden. Ein Beispiel ist die Reaktion von Toluol mit Brom. Durch Erwärmen oder durch Lichteinfall reagiert das Brom mit dem Toluol u.a. zu Benzylbromid und Bromwasserstoff, wobei die Flüssigkeit, die vorher braun war, entfärbt wird.[5]
- Toluol und Brom reagieren zu Benzylbromid und Bromwasserstoff
Auch aus Natriumbromid kann Bromwasserstoff freigesetzt werden. Hierzu wird konzentrierte Phosphorsäure bei schwach erhöhter Temperatur auf den Feststoff getropft.

- Natriumbromid reagiert mit Phosphorsäure unter Entstehung von Bromwasserstoff und Dinatriumhydrogenphosphat
Alternativ kann auch Essigsäure anstatt Phosphorsäure verwendet werden:
Reaktion mit Wasser
Wird Bromwasserstoff in Wasser gelöst, dissoziert das Bromwasserstoff-Molekül, es bilden sich Oxonium- und Bromidionen. Daher sinkt der pH-Wert, die Lösung reagiert als starke Säure.
Sicherheitshinweise
Durch Säurebildung in Wasser wirkt Bromwasserstoffgas reizend auf Augen und Atemwege und in hoher Konzentration auch giftig. (Gas-)Vergiftungen sind jedoch selten, weil es meist als wässrige Lösung (s.o.) verwendet wird und nach eventuellem Ausgasen rasch Nebel bildet. Bei vollständiger Verbrennung bromhaltiger organischer Stoffe kann neben Bromwasserstoff auch elementares Brom entstehen, das wesentlich giftiger ist.
Einzelnachweise
- ↑ Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f g Eintrag zu Bromwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29.12.2007 (JavaScript erforderlich)
- ↑ pKs Tabelle www.chemiekurs.at
- ↑ Eintrag zu CAS-Nr. 10035-10-6 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 282-6.
Weblinks
- Sicherheitsdatenblatt (PDF-Datei; 114 kB)
Halogenwasserstoffe und zugehörige SäurenHalogenwasserstoffe: Fluorwasserstoff | Chlorwasserstoff | Bromwasserstoff | Iodwasserstoff | Astatwasserstoff
Halogenwasserstoffsäuren: Flusssäure | Salzsäure | Bromwasserstoffsäure | Iodwasserstoffsäure
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Bromwasserstoff — HBr entsteht wie Chlorwasserstoff aus den Elementen, bei Zersetzung von Brommetallen durch Schwefelsäure, bei Einwirkung von Brom auf roten Phosphor und wenig Wasser, namentlich auch bei Einwirkung von Brom auf wasserstoffhaltige Körper (auch… … Meyers Großes Konversations-Lexikon
Bromwasserstoff — oder Bromwasserstoffsäure HBr, in Eigenschaften und Zusammensetzung dem Chlorwasserstoffe (Salzsäure, s.d.) entsprechend. Die Säure ist ihres hohen Preises wegen für technische Zwecke ohne Bedeutung. Käufliche Bromwasserstoffsäure enthält gegen… … Lexikon der gesamten Technik
Bromwasserstoff — Brom|was|ser|stoff 〈m. 1; Chem.〉 Verbindung des Broms mit Wasserstoff, chem. Formel HBr * * * Brom|was|ser|stoff; systematische Syn.: Broman, Hydrogenbromid: HBr; farbloses, ätzendes, stechend riechendes u. an Luft rauchendes Gas, Sdp. ‒67 °C,… … Universal-Lexikon
HBr — Strukturformel Allgemeines Name Bromwasserstoff Andere Namen Hydrogenbromid … Deutsch Wikipedia
Hydrogenbromid — Strukturformel Allgemeines Name Bromwasserstoff Andere Namen Hydrogenbromid … Deutsch Wikipedia
Brom — Eigenschaften … Deutsch Wikipedia
Plasma-Ätzen — Plasmaätzen ist ein materialabtragendes, plasmaunterstütztes, gaschemisches Trockenätz Verfahren, das besonders in der Halbleitertechnik, Mikrostrukturtechnologie und in der Displaytechnik großtechnisch eingesetzt wird. Der Begriff Plasmaätzen… … Deutsch Wikipedia
RIE-Prozess — Plasmaätzen ist ein materialabtragendes, plasmaunterstütztes, gaschemisches Trockenätz Verfahren, das besonders in der Halbleitertechnik, Mikrostrukturtechnologie und in der Displaytechnik großtechnisch eingesetzt wird. Der Begriff Plasmaätzen… … Deutsch Wikipedia
Astatwasserstoff — Halogenwasserstoffe sind chemische Verbindungen, die aus den entsprechenden Halogenen mit Wasserstoff gebildet werden. Die allgemeine Summenformel lautet HX, wobei X für das Halogen steht. Ihre wässrigen Lösungen nennt man… … Deutsch Wikipedia
Halogenwasserstoff — Halogenwasserstoffe sind chemische Verbindungen, die aus den entsprechenden Halogenen mit Wasserstoff gebildet werden. Die allgemeine Summenformel lautet HX, wobei X für das Halogen steht. Ihre wässrigen Lösungen nennt man… … Deutsch Wikipedia