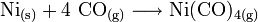- Ni(CO)4
-
Strukturformel 
Allgemeines Name Nickeltetracarbonyl Andere Namen - Nickelcarbonyl
- Tetracarbonylnickel
- "liquid death"
Summenformel Ni(CO)4 CAS-Nummer 13463-39-3 PubChem 518772 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 170,73 g·mol-1 Aggregatzustand flüssig
Dichte 1,32 g·cm−3[1]
Schmelzpunkt Siedepunkt 45 °C[1]
Dampfdruck Löslichkeit gut in unpolaren Lösungsmitteln, schlecht in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Leicht-
entzündlichSehr giftig Umwelt-
gefährlich(F) (T+) (N) R- und S-Sätze R: 61-11-26-40-50/53 S: 45-53-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nickeltetracarbonyl ist eine farblose Flüssigkeit. Diese Substanz gehört zu der Gruppe der Metallcarbonyle. Von besonderer Bedeutung ist Nickeltetracarbonyl bei der Herstellung von Reinstnickel und als Katalysator.
Inhaltsverzeichnis
Geschichte
Nickeltetracarbonyl wurde 1890 vom deutsch-englischen Chemiker Ludwig Mond entdeckt.
Gewinnung und Darstellung
Nicketetracarbonyl bildet sich beim Kontakt von fein verteiltem Nickelpulver mit Kohlenmonoxid bei 80 °C. Nach seinem Entdecker nennt man diese Synthese auch Mond-Verfahren:
Chemische Eigenschaften
Nickeltetracarbonyl entzündet sich bei über 60 °C an der Luft. Es reagiert heftig mit Oxidationsmitteln (Explosionsgefahr). Es zersetzt sich oberhalb von ca. 160°C in elementares Nickel und Kohlenmonoxid. In Nickeltetracarbonyl hat Nickel die in Verbindungen sonst seltene Oxidationszahl 0.
Verwendung
Reinstnickel mit einem Gehalt > 99,9 % wird durch thermische Zersetzung von (destillativ leicht zu reinigendem) Nickeltetracarbonyl dargestellt (siehe Mond-Verfahren). Nickeltetracarbonyl dient vielfach als Grundstoff für metallorganische Ni-Verbindungen, die u.a. als vielseitige Katalysatoren benutzt werden. Die Verbindung dient auch als Katalysator bei der Hydrocarboxylierung.
Sicherheitshinweise
Nickeltetracarbonyl ist sehr giftig und vermutlich krebserregend. An der Luft kann es sich selbstentzünden (Explosionsgefahr).
Quellen
- ↑ a b c d Eintrag zu CAS-Nr. 13463-39-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 17.8.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 13463-39-3 im European chemical Substances Information System ESIS
Weblinks
Wikimedia Foundation.