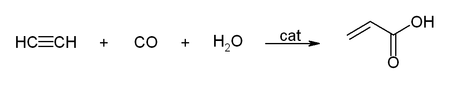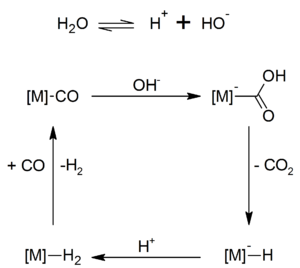- Metallcarbonyle
-
Metallcarbonyle sind Komplexverbindungen von Übergangsmetallen mit Kohlenstoffmonoxid-Liganden. Sie treten in Form neutraler Komplexe, als positiv geladene Metallcarbonyl-Kationen oder als negativ geladene Metallcarbonylat-Anionen auf. Komplexe, die nur Kohlenstoffmonoxid als Ligand enthalten, werden als reine oder homoleptische Metallcarbonyle bezeichnet. Enthalten die Komplexe neben Kohlenstoffmonoxid noch andere Liganden, werden die Komplexe gemischte oder heteroleptische Metallcarbonyle genannt. Kohlenstoffmonoxid kann terminal an ein einzelnes oder verbrückend an mehrere Metallatome gebunden sein.
Die Verbindungen finden Verwendung in der organischen Synthese und als Katalysatoren oder Katalysatorvorstufen in der homogenen Katalyse, etwa bei der Hydroformylierung und der Reppe-Chemie. Im Mond-Verfahren wird das Metallcarbonyl Nickeltetracarbonyl verwendet, um reines Nickel herzustellen. In der metallorganischen Chemie dienen Metallcarbonyle als Vorstufen für andere Komplexverbindungen sowie dem Studium von Metall-Metall-Bindungen.
Metallcarbonyle können durch Hautkontakt, Einatmen oder Verschlucken giftig wirken, etwa durch ihre Fähigkeit, Kohlenstoffmonoxid freizusetzen, welches sich an Hämoglobin bindet und damit den Sauerstofftransport im Blut unterbindet.
Inhaltsverzeichnis
Geschichte
Erste Versuche zur Umsetzung von Kohlenstoffmonoxid mit Metallen führte Justus von Liebig im Jahr 1834 durch. Durch Überleiten von Kohlenstoffmonoxid über geschmolzenes Kalium gelangte er zu einer Substanz mit der Summenformel KCO, die er Kohlenoxidkalium nannte.[1] Wie später gezeigt wurde, handelt es sich bei der dargestellten Verbindung jedoch nicht um ein Metallcarbonyl, sondern um das Kaliumsalz des Hexahydroxybenzols beziehungsweise das Kaliumsalz des Dihydroxyacetylens.[2]
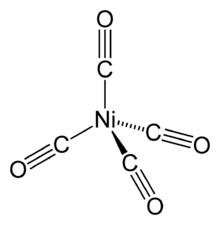
Die Synthese des ersten echten, allerdings heteroleptischen Metallcarbonyl-Komplexes gelang Paul Schützenberger im Jahre 1868 durch Überleiten von Chlor und Kohlenstoffmonoxid über Platinmohr, wobei Dicarbonyldichloroplatin gebildet wurde.[3] Ludwig Mond, einer der Mitbegründer der Imperial Chemical Industries, untersuchte in den Jahren um 1890 zusammen mit Carl Langer und Friedrich Quincke verschiedene Verfahren zur Rückgewinnung des beim Solvay-Verfahren verlorengehenden Chlors mittels Nickelmetall, -oxiden und -salzen.[2] Bei den Versuchen wurde unter anderem Nickel mit Kohlenstoffmonoxid behandelt. Dabei stellten sie fest, dass das entstehende Gas die Gasflamme eines Bunsenbrenners grünlich-gelb färbte und beim Erhitzen im Glasrohr einen Nickelspiegel bildete. Das Gas ließ sich zu einer farblosen, wasserklaren Flüssigkeit mit einem Siedepunkt von 43 °C kondensieren. Damit hatte die Gruppe um Mond mit Nickeltetracarbonyl den ersten reinen, homoleptischen Metallcarbonylkomplex entdeckt.[4] Die für eine Metallverbindung ungewöhnliche Leichtflüchtigkeit des Nickeltetracarbonyls veranlasste Lord Kelvin zu der Aussage, dass es Mond gelungen war, „den Metallen Flügel zu geben“.[5]
Im Jahr darauf berichtete Mond zeitgleich mit Marcelin Berthelot über die Darstellung von Eisenpentacarbonyl nach einem verwandten Verfahren. Mond erkannte das wirtschaftliche Potenzial dieser Verbindungsklasse, die er im Mond-Verfahren nutzte und ließ in seinem Unternehmen weiter nach verwandten Verbindungen forschen. Seine Mitarbeiter Heinrich Hirtz und M. Dalton Cowap stellten weitere Metallcarbonyle von Cobalt, Molybdän und Ruthenium sowie Dieisennonacarbonyl dar.[6] Die Strukturaufklärung des Dieisennonacarbonyls, welches aus Eisenpentacarbonyl durch Einwirkung von Sonnenlicht entsteht, gelang erst James Dewar und H. O. Jones im Jahr 1906.[7] Nach dem Tod von Mond im Jahr 1909 geriet die Chemie der Metallcarbonyle einige Jahre in Vergessenheit. Die BASF nahm 1924 die großtechnische Produktion von Eisenpentacarbonyl nach einem Verfahren von Alwin Mittasch auf, welches zu hochreinem Eisen, so genanntem Carbonyleisen, und Eisenoxidpigment weiterverarbeitet wurde.[8] Erst 1927 gelang A. Job und A. Cassal mit der Darstellung von Chromhexacarbonyl und Wolframhexacarbonyl die Synthese weiterer homoleptischer Metallcarbonyle.
Die Arbeiten von Walter Hieber leisteten in den darauf folgenden Jahren ab 1928 einen entscheidenden Beitrag zur Weiterentwicklung der Metallcarbonylchemie. Er untersuchte sie systematisch und entdeckte unter anderem die Hiebersche Basenreaktion, die zu den ersten bekannten Metallcarbonylhydriden führte und Synthesewege zu Metallcarbonylen wie Dirheniumdecacarbonyl eröffnete.[9] Hieber, der ab 1934 Direktor des Anorganisch-chemischen Instituts der Technischen Universität München war, veröffentlichte in vier Jahrzehnten 249 Arbeiten zur Metallcarbonylchemie.[2]
Ebenfalls in den 1930er Jahren entdeckte Walter Reppe, ein Industriechemiker und späteres Vorstandsmitglied der BASF, eine Reihe homogenkatalytischer Verfahren, wie etwa die Hydrocarboxylierung zur Umsetzung von Olefinen oder Alkinen mit Kohlenstoffmonoxid und Wasser zu Produkten wie ungesättigten Carbonsäuren und deren Derivaten.[2] Bei diesen Reaktionen finden zum Beispiel Nickeltetracarbonyl oder Cobaltcarbonyle als Katalysatoren Verwendung.[10] Auch die Cyclotrimerisierung und –tetramerisierung von Acetylen und seinen Derivaten zu Benzol und Benzolderivaten sowie Cyclooctatetraen gelang Reppe mit Metallcarbonylkatalysatoren. Die BASF baute in den 1960er Jahren eine Produktionsstätte für Acrylsäure nach dem Reppe-Verfahren, die erst 1996 durch modernere Verfahren auf Basis der katalytischen Propylenoxidation verdrängt wurde.
Im Jahr 1938 entdeckte Otto Roelen am damaligen Kaiser-Wilhelm Institut für Kohlenforschung die Synthese von Fettalkoholen mittels homogenkatalytischer Hydroformylierung. Dabei werden Olefine mit Kohlenstoffmonoxid und Wasserstoff unter Verwendung von Cobaltcarbonylen großtechnisch zu Aldehyden und Alkoholen umgesetzt. Mittels Hydroformylierung werden bis heute jährlich mehrere Millionen Tonnen verschiedener Produkte hergestellt.[11]
Im Jahr 1964 entdeckte E. O. Fischer, der bei Walter Hieber über Metallcarbonylchemie promoviert hatte, den ersten Carbenkomplex, indem er Wolframhexacarbonyl analog zur Hieberschen Basenreaktion mit Butyllithium umsetzte. Seine Arbeiten wurden im Jahr 1973 mit dem Nobelpreis für Chemie ausgezeichnet.
Gegenstand der metallorganischen Forschungen waren auch substituierte Metallcarbonyle, bei denen Kohlenstoffmonoxidliganden durch andere Liganden wie Phosphine oder Cyclopentadienylanionen (Halbsandwichkomplexe) ersetzt sind. Ein von Lauri Vaska synthetisierter gemischter Iridium-Carbonylkomplex (Vaskas Komplex) zeigt eine reversible Bindung von Sauerstoff und dient als Modellsubstanz für die Untersuchung des Sauerstofftransports im Blut. Rowland Pettit entdeckte 1965, dass Metallcarbonyle der Stabilisierung antiaromatischer Zustände dienen können.[12]
 Roald Hoffmann
Roald Hoffmann
Im Bereich der organischen Chemie fanden Metallcarbonyle zunehmend Verwendung. Im Jahr 1971 wurde die Pauson-Khand-Reaktion entdeckt, bei der Kohlenstoffmonoxid mit einem Olefin und einem Alkin zu substituierten Cyclopentenonen reagiert. Als Kohlenstoffmonoxidlieferant diente Dicobaltoctacarbonyl. Bereits 1973 gelang es, eine katalytische Variante des Verfahrens zu entwickeln.[13] Wolfgang A. Herrmann gelang 1982 durch Oxidation eines Kohlenstoffmonoxidliganden mit Trimethylaminoxid die Darstellung eines gemischten zweikernigen Metallcarbonylkomplexes, der eine Metall-Metall-Doppelbindung aufweist.[14]
Die Struktur der Metallcarbonyle blieb lange Zeit Gegenstand von Spekulationen. Für Nickeltetracarbonyl wurde zunächst eine ionische Struktur mit einem Tetracarbonyldianion [C4O4]2− vermutet. Basierend auf dem Elektroneutralitätsprinzip schlug Irving Langmuir im Jahr 1921 eine Struktur mit Nickel-Kohlenstoffdoppelbindung vor.[15] Auch Arbeiten von Linus Pauling 1935 kamen zu dem Schluss, dass Nickeltetracarbonyl ein tetraedrischer Komplex mit Resonanzstrukturen mit Doppelbindungscharakter sei. Der Doppelbindungscharakter der Nickel-Kohlenstoffbindung wurde auf Grund der Bindungslänge von 182 pm von Pauling mit 78 Prozent angegeben.[16] Im Jahr 1981 erhielten Roald Hoffmann und Fukui Ken’ichi den Nobelpreis für Chemie für ihr Konzept der Molekülorbitaltheorie und der Isolobalanalogie, mit dem unter anderem die Strukturen und die Chemie von Metallcarbonylen elegant beschrieben werden können.[17]
Der Ersatz des Kohlenstoffmonoxids durch maßgeschneiderte Liganden, etwa durch im Phenylrest sulfoniertes Triphenylphosphan, erlaubte die Herstellung gemischter Metallcarbonyle, deren Eigenschaften gezielt den Anforderungen technischer Prozesse angepasst wurden. Komplexe dieser Art finden in großtechnischen Verfahren wie dem Monsanto-Prozess zur industriellen Darstellung von Essigsäure aus Methanol und Kohlenstoffmonoxid Verwendung. Im Jahr 2009 wurde der Einsatz von Metallcarbonylen in der Krebstherapie untersucht, bei der durch lichtinduzierte Reduktion gezielt Kohlenstoffmonoxid freigesetzt wird, um Krebszellen kontrolliert abzutöten.[18][19]
Vorkommen
 Das galaktische Zentrum (links oben) im infraroten Spektrum, verdeckt von Staubwolken (Aufnahme: 2MASS)
Das galaktische Zentrum (links oben) im infraroten Spektrum, verdeckt von Staubwolken (Aufnahme: 2MASS)
Bei der Untersuchung des Infrarot-Spektrums des galaktischen Zentrums wurden Kohlenstoffmonoxid-Schwingungen von Eisencarbonylen in interstellaren Staubwolken nachgewiesen.[20] Eisencarbonyl-Cluster wurden auch in Jiange H5-Chondriten mittels Infrarotspektroskopie identifiziert. Dabei wurden vier Infrarot-Streckschwingungen gefunden, die terminalen- und verbrückenden Kohlenstoffmonoxid-Liganden zugeordnet werden können.[21]
In der sauerstoffreichen irdischen Atmosphäre unterliegen Metallcarbonyle schnell der Oxidation zum Metalloxid. Es wird diskutiert, ob in reduzierenden hydrothermalen Umgebungen der präbiotischen Urzeit solche Komplexe entstanden und als Katalysatoren für die Synthese von kritischen biochemischen Verbindungen wie Brenztraubensäure zur Verfügung gestanden haben könnten.[22] Verschiedene Metallcarbonyle wie Eisen-, Nickel- und Wolframcarbonyl wurden als Spurenverunreinigung in den gasförmigen Ausdünstungen im Klärschlamm kommunaler Kläranlagen nachgewiesen.[23]
Biologische Bedeutung haben kohlenstoffmonoxidhaltige Komplexe des Hämoglobins und des Myoglobins.[24] Hydrogenasen enthalten zum Teil an Eisen gebundenes Kohlenstoffmonoxid.[25]
In technischen Prozessen, bei denen kohlenstoffmonoxidhaltige Gase unter Druck verwendet werden, kann bei unsachgemäßer Materialauswahl regelmäßig die Bildung von Metallcarbonylen beobachtet werden, verbunden mit der Korrosion durch Bildung von Eisen- und Nickelcarbonylen.[8] So wurde früher bei der Verwendung von kohlenstoffmonoxidhaltigen Steinkohlengas ein rotbrauner, eisenhaltiger Belag auf Glühstrümpfen beobachtet, der aus der Oxidation von im Gas enthaltenen Eisencarbonyl stammte und die Leuchtkraft reduzierte.[8] Bei heterogenkatalytischen Prozessen wird eine Deaktivierung des Kontaktes infolge irreversibler Zersetzung von Metallcarbonylen auf der Kontaktoberfläche beobachtet. Im Hochofenprozess wird die intermediäre Bildung von Eisencarbonylen während der Reduktion des Eisenerzes angenommen.
Für die Aufbewahrung von kohlenstoffmonoxidhaltigen Prüfgasen empfiehlt sich die Verwendung von Aluminiumflaschen, um die Bildung von Eisenpentacarbonyl zu vermeiden.[26]
Herstellung
 Isolobalfragmente mit Tetraeder- beziehungsweise Oktaedergeometrie
Isolobalfragmente mit Tetraeder- beziehungsweise Oktaedergeometrie
Die Verbindungsklasse der Metallcarbonyle ist vor allem seit den Arbeiten Hiebers Gegenstand intensiver metallorganischer Forschung. Seither wurden viele Syntheseverfahren für die Darstellung von einkernigen Metallcarbonylen bis hin zu komplexen homo- und heterometallischen Clustern entwickelt. Da diese Verbindungen zum Teil außerordentlich empfindlich gegenüber Luft, Licht, Feuchtigkeit und Temperatur sind, wurde die Schlenk-Technik angewendet. Ferner etablierten sich Darstellungsmethoden unter Druck bis 500 bar in mit Silber oder Kupfer ausgekleideten Autoklaven.[2]
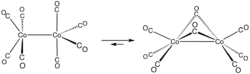
Für das gezielte Design neuer Komplexe bietet sich das Konzept der Isolobalanalogie an. Dabei stellen Metallcarbonylfragmente M(CO)n Teile oktaedrischer Bausteine dar, die in Analogie zur organischen Chemie der tetraedischen CH3-, CH2- oder CH-Fragmente kombinierbar sind. Im Beispiel des Dimangandecacarbonyls liegen im Sinne der Isolobalanalogie zwei d7Mn(CO)5-Fragmente vor, die isolobal zum Methylradikal CH3• sind. Diese lassen sich analog zur Kombination der Methylradikale zum Ethan zum Dimangandecacarbonyl kombinieren. Das Vorliegen von isolobalanalogen Fragmenten muss nicht bedeuten, dass sich die gewünschten Strukturen auch wirklich darstellen lassen. In seinem Nobelpreisvortrag betonte Hoffmann, dass die Isolobalanalogie ein nützliches, aber einfaches Modell sei und in bestimmten Fällen nicht zum Erfolg führt.[17]
Direkte Umsetzung von Metall mit Kohlenstoffmonoxid
Nickeltetracarbonyl und Eisenpentacarbonyl können durch Umsetzung von fein verteiltem Metall mit Kohlenstoffmonoxid gemäß folgender Gleichungen hergestellt werden:
Nickeltetracarbonyl bildet sich mit Kohlenstoffmonoxid bereits bei 80 °C und Normaldruck, feinverteiltes Eisen reagiert bei Temperaturen zwischen 150 und 200 °C und einem Kohlenstoffmonoxiddruck von 50 bis 200 bar.[8] Carbonyle anderer Metalle entstehen auf diesem Syntheseweg nicht. Diese Selektivität erklärt auch die hohe Reinheit von Carbonyleisen.
Reduktion von Metallsalzen- und Oxiden
Eine weitere Möglichkeit der Darstellung von Metallcarbonylen besteht in der Reduktion von Metallhalogeniden mit einem Reduktionsmittel unter Kohlenmonoxiddruck. Als Reduktionsmittel dienen unter anderen metallisches Kupfer oder Aluminium, Wasserstoff, Kohlenstoffmonoxid oder Metallalkyle wie Triethylaluminium. In guter Ausbeute verläuft etwa die Darstellung von Chromhexacarbonyl aus wasserfreiem Chrom(III)-chlorid in Benzol mit Aluminium als Reduktionsmittel und Aluminiumchlorid als Katalysator:
Wird Kohlenstoffmonoxid bei geeigneten Konditionen im Überschuss eingesetzt, kann dieses als Reduktionsmittel fungieren. Eine der ersten bekannten Synthesen nach diesem Verfahren gelang Walter Hieber und H. Fuchs mit der Darstellung von Dirheniumdecacarbonyl aus dem Oxid im Jahr 1941.[28]
Beim Einsatz von Metalloxiden bildet sich als Oxidationsprodukt Kohlenstoffdioxid. Bei der Reduktion von Metallchloriden mit Kohlenstoffmonoxid entsteht Phosgen, etwa bei der Darstellung von Osmiumcarbonylchlorid aus dem Chlorid.[2] Kohlenstoffmonoxid eignet sich auch für die Reduktion von Sulfiden, wobei Carbonylsulfid entsteht.
Beim Einsatz von Metallalkylen als Reduktionsmittel erfolgt eine oxidative Kupplung des Alkylrests zum Dimer. Als Metallalkyle eignen sich Triethylalumium oder Diethylzink, die Umsetzung erfolgt in Diethylether als Lösungsmittel.
Die Reduktion von Wolfram-, Molybdän-, Mangan- und Rhodiumsalzen ist auch mit Lithiumaluminiumhydrid als Reduktionsmittel in Diethylether möglich.
Die Darstellung von Vanadiumhexacarbonyl gelingt mit Natrium als Reduktionsmittel in chelatisierenden Lösungsmitteln wie Diglyme.[29]
In wässriger Phase lassen sich zum Beispiel Nickel- oder Colbaltsalze mit Natriumdithionit reduzieren. Unter Einwirkung von Kohlenstoffmonoxid bildet sich aus Cobaltsalzen quantitativ das Cobaltcarbonylat.[29]
Photo- und Thermolyse
Die mit Metall-Metall-Bindungen ausgestatteten Carbonyle wie beispielsweise Dieisennonacarbonyl (Fe2(CO)9) kann man durch Photolyse oder Thermolyse aus den einkernigen Carbonylen erhalten. Beim weiteren Erhitzen zerfallen die Komplexe letztendlich in das Metall und Kohlenstoffmonoxid.
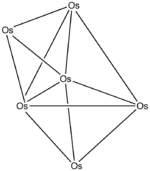
Die thermische Zersetzung von Triosmiumdodecacarbonyl (Os3(CO)12) liefert höherkernige Osmiumcarbonylcluster wie Os4(CO)13 über Os6(CO)18 bis zum Os8(CO)23.[29]
Salzmetathese
Durch die Salzmetathese zum Beispiel von KCo(CO)4 mit [Ru(CO)3Cl2]2 lassen sich auch gezielt gemischtmetallische Metallcarbonyle wie RuCo2(CO)11 darstellen.[30]
Metallcarbonyl-Kationen und -carbonylate
Die Darstellung ionischer Verbindungen ist durch Oxidation beziehungsweise Reduktion aus den Neutralkomplexen möglich. Die kationischen Hexacarbonylsalze des Mangans, Technetiums und Rheniums lassen sich aus den Carbonylhalogeniden unter Kohlenstoffmonoxiddruck durch Umsetzung mit einer Lewis-Säure darstellen.
Durch die Verwendung von starken Säuren gelang auch die Darstellung von Goldcarbonylkationen wie [Au(CO)2]+, welches als Katalysator für die Carbonylierung von Olefinen verwendet wird.[31] Der kationische Platincarbonylkomplex [Pt(CO)4]+ ist durch die Arbeit in sogenannten Supersäuren wie Antimonpentafluorid zugänglich.
Metallcarbonylate sind beispielsweise durch Reduktion zweikerniger Komplexe mit Natrium erhältlich. Ein bekanntes Beispiel ist das Natriumsalz des Eisentetracarbonylats (Na2Fe(CO)4, Collman’s Reagenz), das in der organischen Synthese angewendet wird.
Eigenschaften
Physikalische Eigenschaften
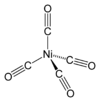
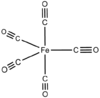
Die einkernigen Carbonylkomplexe der Metalle der achten Nebengruppe sind häufig farblose bis gelbliche Flüssigkeiten, die leicht flüchtig und hochgiftig sind. Die Dämpfe der Nickel- und Eisencarbonyle bilden mit Luft explosionsfähige Gemische.[29] Die Carbonyle der Metalle der sechsten Nebengruppe sind farblose Kristalle, die unter Zersetzung schmelzen. Vanadiumhexacarbonyl, ein 17-Elektronenkomplex, ist ein blauschwarzer Feststoff.[32]
Die zweikernigen Metallcarbonyle der ersten Nebenperiode sind gelb bis orange, die der höheren Perioden sind farblos. Mehrkernige Metallcarbonyle sind gelbe, rote bis schwarze Kristalle; Trieisendodecacarbonyl (Fe3(CO)12) bildet tiefgrüne Kristalle. Die kristallinen Metallcarbonyle sind im Vakuum sublimierbar, teilweise unter Zersetzung.[32]
Metallcarbonyle sind löslich in vielen organischen Lösungsmitteln wie Benzol, Diethylether, Aceton, Eisessig und Tetrachlorkohlenstoff, jedoch nicht in Wasser. In Mineralsäuren lösen sich Metallcarbonyle unter Gasentwicklung und der Bildung der Metallsalze.[8]
Molekulare Eigenschaften
Bindung
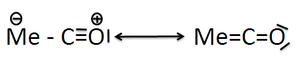
Metallcarbonyle werden durch die synergistischen σ-Donor/π-Akzeptor-Wechselwirkungen des Kohlenstoffmonoxids mit dem Metall besonders stabilisiert. Durch diese Wechselwirkungen wird die Elektronendichte vom gefüllten σ*-Orbital der C-O-Bindung in die leeren d-Orbitale (präziser: in symmetrieäquivalente Orbitale) des Metalls und von gefüllten Metallorbitalen in die leeren π*-Orbitale der C-O-Mehrfachbindung verschoben.
Hierdurch erfährt der gesamte Komplex eine Elektronendelokalisierung und damit eine energetische Stabilisierung (nephelauxetischer Effekt). Es existiert ferner eine π-Donor-Wechselwirkung, die jedoch schwach ist und daher oft vernachlässigt wird. Nach Linus Pauling lässt sich die Struktur durch die Resonanz der folgenden Grenzstrukturen erklären.
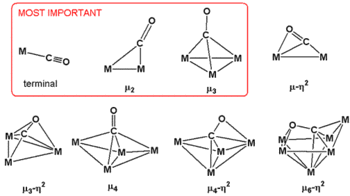
Kohlenstoffmonoxid kann in Metallcarbonylen verschiedene Bindungsmodi aufweisen. Diese unterscheiden sich in der Haptizität und dem Verbrückungsmodus. Die Haptizität beschreibt die Anzahl der Kohlenstoffmonoxidatome, die direkt an das Zentralatom gebunden sind. Die Benennung erfolgt durch den Buchstaben ηn, welcher dem Namen des Komplexes vorangestellt wird. Der hochgestellte Index n gibt die Anzahl der gebundenen Atome an. Ist die Haptizität 1 (Monohapto-Koordination), wie etwa bei terminal gebundenem Kohlenstoffmonoxid, erfolgt meist keine gesonderte Benennung. Ist Kohlenstoffmonoxid sowohl über das Kohlenstoff- als auch über das Sauerstoffatom an das Metall gebunden, wird dies als Dihapto-Koordination η2 bezeichnet.
Der Verbrückungsmodus beschreibt die Anzahl der Metallatome, die von einem Ligandatom überbrückt werden. Die Benennung erfolgt mit dem Buchstaben μm, der tiefgestellte Index m gibt die Anzahl der überbrückten Metallatomen an. Bei zwei überbrückten Zentren wird der tiefgestellte Index zum Teil nicht ausgeschrieben, so dass μ der Schreibweise μ2 entspricht.
Kohlenstoffmonoxid kann in den Komplexen terminal, verbrückend als μ2 und facial als μ3 und als Vier-Elektronen-Donor in einer μ3 als μ2-η2-Brücke auftreten. Die Tendenz zur Brückenbildung des Kohlenstoffmonoxidliganden sinkt mit steigendem Atomradius des Zentralatoms.
Strukturen kleiner Metallcarbonyle
Die Strukturen der Metallcarbonyle werden in erster Linie durch das VSEPR-Modell und die 18-Elektronen-Regel, bei komplizierteren Strukturen mithilfe des Isolobalkonzepts vorhergesagt. Komplexe mit Metallen höherer Perioden bilden im Vergleich zu denen niedrigerer Perioden bevorzugt weniger C-O-Brücken aus, was unter anderem auf die nach der Ligandenfeldtheorie größeren Aufspaltung der Metall-Valenzorbitale und die damit verbundene low-spin-Konfiguration zurückzuführen ist.
Struktur von Metallcarbonylclustern
Cluster sind laut einer Definition von F. A. Cotton Moleküle, in denen zwei oder mehr Metallatome außer an andere Nichtmetallatome auch an sich selbst gebunden sind:
„Metallatomclusterverbindungen können formal als solche definiert werden, die eine endliche Gruppe von Metallatomen enthalten und die ganz, hauptsächlich oder zumindest zu einem erheblichen Teil durch direkte Bindungen zwischen den Metallatomen zusammengehalten werden, obwohl einige Nichtmetallatome eng mit dem Cluster assoziiert sein können“
Je nach Größe der betrachteten Cluster werden verschiedene Ansätze angewendet, um die Strukturen zu beschreiben. Kleine Cluster mit zwei bis sechs Metallgerüstatomen befolgen mit wenigen Ausnahmen die 18-Elektronenregel (EAN, Effective Atomic Number Rule, Sidgwick Rule).
Die Strukturen größerer Cluster mit etwa fünf bis zwölf Gerüstatomen lassen sich anhand modifizierter Wade-Regeln, den so genannten Wade-Mingos-Regeln (Skelett-Elektronenpaar-Theorie) vorhersagen. Nach den Isolobalregeln werden dabei die Komplexfragmente in isolobale Borhydrideinheiten überführt.
„Wir werden zwei Fragmente isolobal nennen, wenn die Anzahl, die Symmetrieeigenschaften, die ungefähre Energie und Gestalt der Grenzorbitale und die Anzahl der Elektronen in diesen ähnlich sind – nicht identisch, aber ähnlich.“
Besonders große Metallcarbonylcluster mit mehr als zwölf Gerüstatomen haben bereits dominant metallischen Charakter, sodass sie eher als metallische Mikrokristallite mit chemisorbiertem Kohlenstoffmonoxid zu beschreiben sind. Die Struktur entspricht einem Ausschnitt aus dem Metallgitter.
Chemische Eigenschaften
Metallcarbonyle stellen wichtige Ausgangsverbindungen für die Darstellung anderer Komplexe dar. Die wichtigsten Reaktionen sind die Substitution des Kohlenstoffmonoxids durch andere Liganden, die Oxidation und Reduktion des Metalls sowie Reaktionen am Kohlenstoffmonoxid.
Die Substitution in 18-Elektronen-Komplexen erfolgt durch einen dissoziativen Mechanismus über eine 16-Elektronen-Stufe. Der Substitution kann thermisch oder photochemisch induziert werden. Bei der photochemisch induzierten Substitution wird durch Lichtabsorption ein antibindendes Molekülorbital des Komplexes besetzt, wodurch die Metall-Kohlenstoff-Bindung geschwächt und der Ligand abgespalten wird. Bei Metallcarbonylclustern, deren Metall-Metall-Bindungen durch Licht gespalten werden können, kann die Substitution durch Oxidation eines Kohlenstoffmonoxidliganden zu Kohlenstoffdioxid mit einem Oxidationsmittel wie Trimethylaminoxid eingeleitet werden.
Der Kohlenstoffmonoxidligand lässt sich oft leicht durch analoge Liganden wie zum Beispiel Phosphane, Cyanid-Ion (CN−), Olefine oder das Nitrosyl-Kation (NO+) substituieren. Die Reaktion wird vorteilhaft in Lösungsmitteln wie Diethylether oder Acetonitril durchgeführt, welche die entstehenden Zwischenstufen als das Sauerstoff- beziehungsweise Stickstoffdonorliganden stabilisieren können. Konjugierte Olefine können pro olefinischer Doppelbindung einen Kohlenstoffmonoxidliganden im Komplex ersetzen.
Die Dissoziationsenergie beträgt 105 kJ•mol−1 für Nickeltetracarbonyl und 155 kJ•mol−1 für Chromhexacarbonyl.[32]
Die Substitution in 17-Elektronen-Komplexen erfolgt nach einem assoziativen Mechanismus über eine 19-Elektronenstufe.
Die Reaktionsgeschwindigkeit nach dem assoziativen Mechanismus ist in vielen Fällen gegenüber dem dissoziativen Mechanismus erhöht. Vanadiumhexacarbonyl reagiert etwa um den Faktor 1010 schneller als Wolframhexacarbonyl. Mittels Elektronentransferkatalyse, etwa durch katalytische Oxidation eines 18-Elektronen- zum 17-Elektronenkomplex, lässt sich die Substitutionsgeschwindigkeit in 18-Elektronenkomplexen erheblich erhöhen.[36]
Mit Reduktionsmitteln wie metallischem Natrium in Ammoniak bilden die Metallcarbonyle Metallcarbonylat-Anionen. Dabei kann es bei mehrkernigen Komplexen auch zur Spaltung der Metall-Metall-Bindung kommen.
Bei der Hieberschen Basenreaktion reagiert das Hydroxid-Ion mit Metallcarbonylen wie Eisenpentacarbonyl unter nukleophilen Angriff am Carbonyl-Kohlenstoffatom unter Freisetzung von Kohlenstoffdioxid und Bildung von Metallcarbonylaten.
In einem weiteren Schritt lässt sich Eisencarbonylhydrid, ein sehr temperatur- und luftempfindliches Komplexhydrid wie beispielsweise auch Cobaltcarbonylhydrid (HCo(CO)4), synthetisieren, das von Walter Hieber 1931 entdeckt wurde:
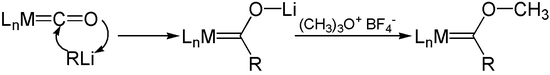
Analog zur Hieberschen Basenreaktion reagieren Organolithium-Verbindungen mit Metallcarbonylen. Durch anschließende Alkylierung mit Meerwein-Salz werden Fischer-Carbene erhalten.
Mit Halogenen reagieren Metallcarbonyle unter oxidativer Halogenierung. Bei mehrkernigen Komplexen kann es dabei zur oxdidativen Spaltung von Metall-Metall-Bindungen kommen.
Ungesättigte Verbindungen oder Quecksilber können in die Metall-Metall-Bindung von mehrkernigen Metallcarbonylen insertieren.
Verwendung
Mond-Verfahren
Beim Mond-Verfahren wird Nickeltetracarbonyl von einer kühleren Zone der Transportapparatur bei circa 80 °C zu einer circa 200 °C heißen Zone transportiert, wo es wieder zu Nickel und Kohlenstoffmonoxid zerfällt. Im Jahr 1910 stellte die Mond-Nickel-Company Ltd. bereits 3000 Tonnen Nickel mit einer Reinheit von 99,9 Prozent her. Das Verfahren wird bis heute angewendet.
Carbonyleisen
Nach einem ähnlichen Verfahren wird Eisenpentacarbonyl zur Darstellung von Carbonyleisen genutzt, einem hochreinen Metallpulver, das unter anderem für die Herstellung von Spulenkernen, Diamantwerkzeuge, Pigmenten, als Nahrungsergänzungsmittel[37] sowie bei der Herstellung Radar-absorbierender Materialien in der Tarnkappentechnik[38] und im Metallspritzguss genutzt wird.
Homogene Katalyse
Die Hydroformylierung wurde 1938 von Otto Roelen entdeckt und dient zur großtechnischen Synthese von Fettalkoholen, die zur Waschmittelherstellung genutzt werden. Heutzutage werden mehrere Millionen Tonnen Oxo-Produkte durch diesen Prozess gewonnen. Die Hydroformylierung zählt zu den atomökonomisch günstigen Verfahren, besonders, wenn die Reaktion mit hoher Regioselektivität verläuft.

Die ursprünglich eingesetzten Cobaltcarbonyle wurden im Monsanto-Prozess durch die aktiveren gemischten Rhodiumcarbonyle ersetzt.
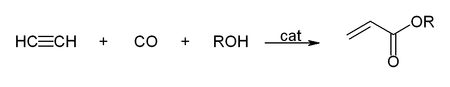
Unter Reppe-Chemie wird das Arbeiten mit Acetylen unter erhöhtem Druck verstanden, wobei Metallcarbonyle und -carbonylwasserstoffe als Katalysator Verwendung finden.[39] Eine wichtige Reaktionen ist die Hydrocarboxylierung, am Beispiel der Acrylsäure- und Acrylsäureester-Herstellung:
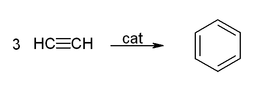
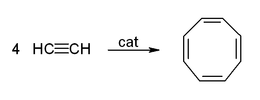
Auch die Cyclisierung und die cyclisierende Polymerisation am Beispiel Benzol- und Cyclooctatetraen-Herstellung nutzt Metallcarbonyle als Katalysator:[40]
Durch die Cotrimerisierung von Blausäure mit Acetylen lassen sich Pyridin und seine Derivate herstellen. Aus der Reppe-Chemie ergeben sich zahlreiche Zwischenprodukte der industriellen Chemie, die als Ausgangsprodukte für Lacke, Klebstoffe, Spritzgussmassen, Schaumstoffe, Textilfasern oder Medikamente in weiteren Verfahrensschritten dienen.
Eisenpentacarbonyl katalysiert die Wassergas-Shift-Reaktion
nach folgendem Mechanismus[41]
Andere Verwendungen
Von Walter Ostwald, dem Sohn Wilhelm Ostwalds, wurde Eisenpentacarbonyl als Antiklopfmittel in Benzin, dem so genannten Motalin eingesetzt.[42] Auf Grund von Ablagerungen von Eisenoxiden im Motorraum und an den Zündkerzen und den damit verbundenen Problemen wurde diese Verwendung jedoch eingestellt.
Bei der Gewinnung von reinem Wasserstoff aus Synthesegas wird die Bildung von Kupfercarbonylen in der letzten Stufe der Kohlenstoffmonoxidabtrennung genutzt.[2] Dazu wird das vorgereinigte Synthesegas durch eine kupferchloridhaltige wässrige Lösung geleitet, in der sich Kohlenstoffmonoxid unter Bildung eines Kupfercarbonyls ([(H2O)2ClCuCO]) bindet.
Die thermische Zersetzung von Metallcarbonylclustern auf Trägermaterialien dient zur Darstellung von Kontakten mit definierter Metallteilchengröße, die in der heterogenen Katalyse Verwendung finden. Auch die Umwandlung der mononuklearen Komplexe in Metallcarbonylcluster in den Hohlräumen von Zeolithen wurde untersucht.[43]
Toxikologie
Die Toxizität eines Metallcarbonyls ist bedingt durch Giftigkeit des Kohlenmonoxids und des Metalls sowie der Volatilität und Instabilität des Komplexes. Die Exposition erfolgt durch Inhalation, bei flüssigen Metallcarbonylen auch durch Verschlucken oder bedingt durch die gute Fettlöslichkeit durch Hautresorption. Die meisten toxikologischen Erfahrungen stammen aus Vergiftungen mit Nickeltetracarbonyl und Eisenpentacarbonyl. Nickeltetracarbonyl gilt als einer der stärksten Inhalationsgifte.[44]
Das Einatmen von Nickeltetracarbonyl verursacht akut nicht-spezifische Symptome ähnlich einer Kohlenmonoxidvergiftung, wie Übelkeit, Reizhusten, Kopfschmerzen, Fieber und Schwindelgefühl. Nach einiger Zeit treten schwere pulmonale Symptome auf, wie Husten, Tachykardie, Zyanose oder auch Probleme im Verdauungstrakt. Zusätzlich zu pathologischen Veränderungen der Lunge, etwa durch Metallierung der Lungenbläschen, und des Gehirns werden Schädigungen der Leber, der Nieren, der Nebennieren und der Milz beobachtet. Eine Metallcarbonylvergiftung bedingt häufig eine langhaltende Rekonvaleszenz.[45]
Eine chronische Exposition durch Einatmen geringer Konzentrationen von Nickeltetracarbonyl kann neurologische Symptome wie Schlaflosigkeit, Kopfschmerzen, Schwindel und Gedächtnisverlust verursachen.[45] Nickeltetracarbonyl gilt als krebserregend, wobei zwischen dem Beginn der Exposition und der klinischen Manifestation des Krebses 20 bis 30 Jahre liegen können.[46]
Analytische Charakterisierung
Wichtige analytische Techniken für die Untersuchung und Charakterisierung von Metallcarbonylen sind die Infrarotspektroskopie und die 13C-NMR-Spektrospkopie. Die Informationen, die diese beiden Techniken liefern, bewegen sich auf verschiedenen Zeitskalen. Infrarotaktive Molekülschwingungen wie C-O-Streckschwingungen sind oft schnell gegenüber intramolekularen Prozessen, während NMR-Übergänge langsamer sind und sich im Zeitbereich von intra- oder sogar intermolekularen Ligandenaustauschprozessen abspielen. Dies kann dazu führen, dass NMR-Daten zeitgemittelte Informationen liefern.[32]
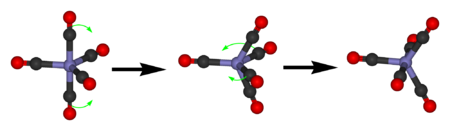
Die Untersuchung von Dicobaltoctacarbonyl (Co2(CO)8) mittels Infrarotspektroskopie liefert Banden für 13 verschiedene CO-Schwingungen und damit erheblich mehr, als für 8 Substituenten zu erwarten ist. Der Grund liegt im gleichzeitigen Vorliegen von verschiedenen Isomeren, etwa mit und ohne verbrückenden CO-Liganden. Die 13C-NMR-Untersuchung der gleichen Substanz liefert nur ein einzelnes Signal bei einer chemischen Verschiebung von 204 ppm. Dies indiziert, dass die Isomere sich schnell ineinander umwandeln.
Auch Eisenpentacarbonyl liefert nur ein einzelnes 13C-NMR-Signal. Der Grund liegt im schnellen Ligandenplatzwechsel durch Berry-Pseudorotation.
Infrarotspektroskopie
Die Untersuchung von Metallcarbonlyen mittels Infrarotspektroskopie liefert vielfältige Informationen, etwa über die Bindungsmodi des Kohlenstoffmonoxids, die Komplexgeometrie und die Ladung des Komplexes. Bei heteroleptischen Metallcarbonylen liefert die Infrarotspektroskopie außerdem Informationen über die Eigenschaften und Bindungsverhältnisse des zum Kohlenstoffmonoxid trans-ständigen Liganden.
Die Wellenzahl der C-O-Streckschwingung νCO des freien Kohlenstoffmonoxids liegt bei 2143 cm−1, die Anzahl und Art der C-O-Valenzschwingung der Metallcarbonyle lässt einen Rückschluss auf die Struktur des Komplexes zu. Außer den CO-Valenzschwingungen sind im beobachten Wellenzahlbereich von circa 1800 bis 2000 cm−1 auch keine weiteren Schwingungen zu erwarten. Mittels Infrarotspektroskopie lassen sich auch terminale und verbrückende Liganden im Komplex unterscheiden.
Komponente νCO (cm−1) CO 2143 Ti(CO)62− 1748 V(CO)6− 1859 Cr(CO)6 2000 Mn(CO)6+ 2100 Fe(CO)62+ 2204 Fe(CO)5 2022, 2000 Außer der Frequenz lässt auch die Anzahl der Schwingungsbanden einen Rückschluss auf die räumliche Struktur des Komplexes zu. Oktaedrische Komplexe wie Cr(CO)6 weisen aufgrund der chemischen Übereinstimmung aller Liganden nur eine einzelne νCO-Bande im Infrarotspekrum auf. Spektren von Komplexen mit niedrigerer Symmetrie sind dagegen komplexer. Das Infrarotspektrum der Dieisennonacarbonlys Fe2(CO)9 weist beispielsweise C-O-Banden bei 2082, 2019 und 1829 cm−1 auf.
Bei mehrkernigen Komplexen lässt die Lage der νCO-Schwingung einen Rückschluss auf die Koordinationsgeometrie des Kohlenstoffmonoxids zu. Für verbrückende, μ2-koordinierende Liganden ist die Lage der νCO-Schwingung um etwa 100 bis 200 cm−1 zu niedrigeren Wellenzahlen gegenüber Kohlenstoffmonoxid in terminaler Position verschoben. Dieser Effekt ist für μ3-verbrückendes Kohlenstoffmonoxid noch ausgeprägter.
Typische Werte für Rhodiumcluster sind wie folgt:[47]
Metallcarbonyl νCO, µ1 (cm−1) νCO, µ2 (cm−1) νCO, µ3 (cm−1) Rh2(CO)8 2060, 2084 1846, 1862 Rh4(CO)12 2044, 2070, 2074 1886 Rh6(CO)16 2045, 2075 1819 Kernspinresonanzspektroskopie
Eine nützliche Methode zur Untersuchung von Metallcarbonylen ist die Kernspinresonanzspektroskopie von Kohlenstoffkernen wie 13C oder auch Metallkernen wie 195Pt, in gemischten Carbonylkomplexen auch Phosphor 31P und Wasserstoffkerne 1H. Zur Verbesserung der Auflösung kommen bei der 13C-NMR-Spektroskopie Komplexe mit künstlich angereicherten 13C-Kohlenstoffmonoxidliganden zum Einsatz. Typische Werte der chemischen Verschiebung liegen für terminal gebundene Liganden bei 150 bis 220 ppm, verbrückende Liganden bei 230 bis 280 ppm.[48] Mit zunehmender Ordnungszahl des Zentralatoms findet eine zunehmende Abschirmung statt.
Die Kernspinresonanzspektroskopie eignet sich zur experimentellen Bestimmung von Phänomenen der Komplexdynamik.[32] Aus der Messung der Temperaturabhängigkeit von Ligandenplatzwechseln lässt sich deren Aktivierungsenergie bestimmen.[49]
Massenspektrometrie
Die Untersuchung von Metallcarbonylen mittels Massenspektrometrie lässt Rückschlüsse auf die Struktur der Komplexe zu. Die dabei meist verwandte Ionisationstechnik ist die Elektrospray-Ionisation (ESI). Dabei werden Lösungen geladener Substanzen versprüht, ionisiert und die Tröpfchen getrocknet, so dass Ionen des Analyten zurückbleiben. Diese Methode ist daher besonders geeignet für ionische Metallcarbonyle. Neutrale Metallcarbonyle können mittels Derivatisierung, etwa durch Umsetzung mit Alkoholaten, in ionische Spezies überführt werden. Durch die Reaktion der Metallcarbonyle mit Aziden entstehen unter Stickstofffreisetzung ionische Isocyanatderivate.[50] Metallcarbonyle ergeben leicht interpretierbare Spektren, da der dominierende Fragmentierungsprozess der Verlust der Carbonylliganden ist.
Bei der Elektrospray-Ionisation-Massenspektrometrie ist die Fragmentierung der Komplexe durch Einstellen der Spannung variierbar. Somit lässt sich sowohl das Molekulargewicht des Ursprungskomplexes ermitteln als auch Informationen über die strukturellen Umlagerungen von Clusterkernen, die unter thermolytischen Bedingungen ihre Kohlenstoffmonoxidliganden partiell oder vollständig verlieren.[51]
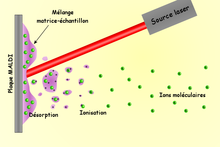
Andere Verfahren wie die Matrix-unterstützte Laser-Desorption/Ionisation (MALDI), die sich für die Massenspektrometrie von hochmolekularen Stoffen bewährt hatten, liefern bei der massenspektrometrischen Untersuchung von Metallcarbonylen nur wenig brauchbare Informationen. Die untersuchten Verbindungen, etwa der Iridiumcarbonylcluster Ir4(CO)12, bildete unter den Untersuchungsbedingungen Cluster mit bis zu 24 Iridium- und 30 bis 35 Carbonylliganden, wobei der Molekülionpeak nicht detektiert wurde.[50]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, S. 1780–1822.
- N. Krause: Metallorganische Chemie – Selektive Synthesen mit metallorganischen Verbindungen. Spektrum Akademischer Verlag, ISBN 3-86025-146-5.
- C. Elschenbroich, A. Salzer: Organometallchemie. Teubner Taschenbücher Chemie, Wiesbaden 1990, ISBN 3-519-23501-3.
- P. J. Dyson, J. S. McIndoe: Transition Metal Carbonyl Cluster Chemistry. Verlag Routledge Chapman & Hall, 2000, ISBN 90-5699-289-9.
- D. Astruc: Organometallic Chemistry and Catalysis. Verlag Springer, Berlin/Heidelberg 2007, ISBN 978-3-540-46128-9.
Weblinks
 Commons: Metallcarbonyle – Sammlung von Bildern, Videos und Audiodateien
Commons: Metallcarbonyle – Sammlung von Bildern, Videos und Audiodateien Wiktionary: metal carbonyl – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: metal carbonyl – Bedeutungserklärungen, Wortherkunft, Synonyme, ÜbersetzungenEinzelnachweise
- ↑ W. E. Trout: The metal carbonyls. In: J. Chem. Educ. 1937, 14 (10), doi:10.1021/ed014p453, S. 453.
- ↑ a b c d e f g W. A. Herrmann: 100 Jahre Metallcarbonyle. In: Chemie in unserer Zeit. 1988, 22. Jahrg., Nr. 4, ISSN 0009-2851, S. 113–122.
- ↑ P. Schützenberger In: Ann. Chim. Phys. (Paris) 1868, 15, S. 100–106.
- ↑ L. Mond, C. Langer, F. Quincke: Action of Carbony Monoxide on Nickel. In: J. Chem. Soc.. 1890, 57, doi:10.1039/CT8905700749, S. 749–753.
- ↑ W. Gratzer: Metal takes Wing. In: Eurekas and Euphorias: The Oxford Book of Scientific Anecdotes. Verlag Oxford Univ Press, 2002, ISBN 0-19-280403-0.
- ↑ L. Mond, H. Hirtz, M. D. Cowap: Note on a Volatile Compound of Cobalt With Carbon Monoxide. In: Chem. News. vol. 98, 1908, S. 165; Chem. Abs. vol. 2, 1908, S. 3315.
- ↑ J. Dewar, H. O. Jones: The Physical and Chemical Properties of Iron Carbonyl. In: Proc. R. Soc. Lond. A. 6. Dezember 1905, 76, doi:10.1098/rspa.1905.0063, S. 558–577.
- ↑ a b c d e A. Mittasch: Über Eisencarbonyl und Carbonyleisen. In: Angewandte Chemie. Volume 41, Issue 30, 1928, S. 827–833.
- ↑ F. Basolo: From Coello to inorganic chemistry: a lifetime of reactions. S. 101 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ R. A. Sheldon: Chemicals from synthesis gas: catalytic reactions of CO and H2. Band 2, S. 106 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ D. Steinborn: Grundlagen der metallorganischen Komplexkatalyse. S. 83 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ L. Watts, R. Pettit: Chemistry of Cyclobutadiene-iron Tricarbonyl. Werner Centennial, Chapter 34, 1967, S. 549–554; Advances in Chemistry. Volume 62, 1. January 1967, doi:10.1021/ba-1967-0062.ch034.
- ↑ Pauson–Khand-type reaction mediated by Rh(I) catalysts
- ↑ W. A. Herrmann u. a.: Metallcarbonyl-Synthesen. XI. Übergangsmetall–Methylen-Komplexe. XXVI. Zur Reaktivität des Halbsandwich-Komplexes [η5−C5(CH3)5]Rh(CO)2 gegenüber Bronsted-Säuren, Halogenen und Trimethylaminoxid. In: Zeitschrift für anorganische und allgemeine Chemie. Volume 487, Issue 1, S. 85–110, April 1982, doi:10.1002/zaac.19824870109.
- ↑ I. Langmuir: Types of Valence. In: Science. 1921, 54, doi:10.1126/science.54.1386.59, S. 59–67.
- ↑ L. Pauling: Die Natur der chemischen Bindung. 3. Auflage. Verlag Chemie, Weinheim 1968, ISBN 3-527-25217-7.
- ↑ a b c R. Hoffmann: Building Bridges between Inorganic and Organic Chemistry, Nobel lecture, 8. December 1981.
- ↑ H. Pfeiffer, u. a.: Sonogashira and "Click" reactions in the N-terminal and side chain functionalization of peptides with [Mn(CO)3(tpm)]+-based CO releasing molecules (tpm = tris(pyrazolyl)methane. In: Dalton Trans.. 2009, doi:10.1039/b819091g.
- ↑ P. Gasser, u. a.: Synthesis and characterisation of hetero-bimetallic organometallic phenylalanine and PNA monomer derivatives. In: Dalton Trans.. 2009, doi:10.1039/b819169g.
- ↑ A. G. G. M. Tielens, D. H. Wooden, L. J. Allamandola, J. Bregman, F. C. Witteborn: The infrared spectrum of the Galactic center and the composition of interstellar dust. In: Astrophys J.. 10. April 1996, 461 (1 Pt 1), PMID 11539170, S. 210–222.
- ↑ Y. Xu, X. Xiao, S. Sun, Z. Ouyang: IR Spectroscopic Evidence of Metal Carbonyl Clusters in the Jiange H5 Chondrite. In: Lunar and Planetary Science. 1996, 27, S. 1457–1458.
- ↑ G. D. Cody u. a.: Primordial Carbonylated Iron-Sulfur Compounds and the Synthesis of Pyruvate. In: Science. 25. August 2000, Vol. 289, no. 5483, doi:10.1126/science.289.5483.1337, S. 1337–1340.
- ↑ J. Feldmann: Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in sewage gas by using cryotrapping gas chromatography inductively coupled plasma mass spectrometry. In: J. Environ. Monit.. 1999, 1, doi:10.1039/A807277I, S. 33–37.
- ↑ J. N. Moore, P. A. Hansen, R. M. Hochstrasser: Iron-carbonyl bond geometries of carboxymyoglobin and carboxyhemoglobin in solution determined by picosecond time-resolved infrared spectroscopy. In: Proc. Nati. Acad. Sci. USA, July 1988, Vol. 85, S. 5062–5066; PMC 281688.
- ↑ C. Tard, C. J. Pickett: Structural and Functional Analogues of the Active Sites of the [Fe]-, [NiFe]-, and [FeFe]-Hydrogenases. In: Chem. Rev.. 2009, 109 doi:10.1021/cr800542q, S. 2245–2274.
- ↑ H. Schön: Handbuch der Reinsten Gase. 1. Auflage. Verlag Springer, Berlin/Heidelberg 2005, ISBN 3-540-23215-X.
- ↑ a b c d Metallcarbonyle. In: Huheey, E. Keiter, R. Keiter: Anorganische Chemie. 2. Auflage. de Gruyter, Berlin/New York 1995.
- ↑ W. Hieber, H. Fuchs, Z. Anorg. Allgem. Chem.. 1941, 248, S. 256.
- ↑ a b c d A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1780–1822.
- ↑ E. Roland und H. Vahrenkamp: Zwei neue Metallcarbonyle: Darstellung und Struktur von RuCo2(CO)11 und Ru2Co2(CO)13. In: Chemische Berichte. März 1985, Volume 118, Issue 3, doi:10.1002/cber.19851180330, S. 1133–1142.
- ↑ Q. Xu, Y. Imamura, M. Fujiwara, Y. Souma: A New Gold Catalyst: Formation of Gold(I) Carbonyl, [Au(CO)n]+ (n = 1, 2), in Sulfuric Acid and Its Application to Carbonylation of Olefins. In: J. Org. Chem.. 1997, 62 (6), doi:10.1021/jo9620122, S. 1594–1598.
- ↑ a b c d e [[Peter Paetzold]P. Paetzold]]: Chemie: Eine Einführung. S. 870 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ F. A. Cotton: Transition-metal compounds containing clusters of metal atoms. In: Q. Rev. Chem. Soc.. 1966, 20, doi:10.1039/QR9662000389, S. 389–401.
- ↑ Englischer Originaltext: Metal atom cluster compounds can be formally defined as those containing a finite group of metal atoms which are held together entirely, mainly or at least to a significant extent, by bonds directly between the metal atoms even though some non-metal atoms may be associated intimately with the cluster.
- ↑ Englischer Originaltext: We will call two fragments isolobal if the number, symmetry properties, approximate energy and shape of the frontier orbitals and the number of electrons in them are similar-not identical, but similar.
- ↑ H. H. Ohst, J. K. Kochi: Electron-transfer catalysis of ligand substitution in triiron clusters. In: J. Am. Chem. Soc.. 1986, 108 (11), doi:10.1021/ja00271a019, S. 2897–2908.
- ↑ S. J. Fairweather-Tait, B. Teucher: Iron and Calcium Bioavailability of Fortified Foods and Dietary Supplements. In: Nutrition Reviews. 2001, 60, doi:10.1301/00296640260385801, S. 360–367.
- ↑ D. Richardson:Stealth-Kampfflugzeuge: Täuschen und Tarnen in der Luft, 187 Seiten, Verlag Dietikon Zürich (2002), ISBN 3-7276-7096-7.
- ↑ A. Gossauer: Struktur und Reaktivität der Biomoleküle. Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 155.
- ↑ G. Wilke: Organo Transition Metal Compounds as Intermediates in Homogenous Catalytic Reactions.
- ↑ R. H. Crabtree: The Organometallic Chemistry of the Transition Metals. Verlag John Wiley & Sons, 2009, ISBN 0-470-25762-8.
- ↑ H. Offermanns: Der andere Ostwald. In: Nachrichten aus der Chemie. 2009, 57, doi:10.1002/nadc.200970167, S. 1201–1202.
- ↑ G. Schmid: Clusters and Colloids. From Theory to Applications. Verlag Wiley-VCH (1994), ISBN 3-527-29043-5.
- ↑ B. Madea: Rechtsmedizin. Befunderhebung - Rekonstruktion – Begutachtung. Springer-Verlag, 2003, ISBN 3-540-43885-8.
- ↑ a b J. M. Stellman: Encyclopaedia of Occupational Health and Safety. International Labour Org, 1998, ISBN 91-630-5495-7.
- ↑ G. Mehrtens, M. Reichenbach, D. Höffler, Günter G. Mollowitz: Der Unfallmann: Begutachtung der Folgen von Arbeitsunfällen, privaten Unfällen und Berufskrankheiten. Verlag Springer, Berlin/Heidelberg 1998, ISBN 3-540-63538-6.
- ↑ A.D. Allian, Y. Wang, M. Saeys, G.M. Kuramshina, M. Garland: The combination of deconvolution and density functional theory for the mid-infrared vibrational spectra of stable and unstable rhodium carbonyl clusters. In: Vibrational Spectroscopy. 41, 2006, S. 101–111. doi:10.1016/j.vibspec.2006.01.013.
- ↑ C. Elschenbroich, A. Salzer: Organometallchemie. Teubner Taschenbücher Chemie, Wiesbaden 1990, ISBN 3-519-23501-3.
- ↑ E. Riedel, R. Alsfasser, C. Janiak, T. M. Klapötke: Moderne Anorganische Chemie. de Gruyter, 2007, ISBN 3-11-019060-5.
- ↑ a b W. Henderson and J.S. McIndoe: Mass Spectrometry of Inorganic, Coordination and Organometallic Compounds: Tools – Techniques – Tips. Verlag John Wiley & Sons, ISBN 0-470-85015-9.
- ↑ C. P. G. Butcher, P. J. Dyson, B. F. G. Johnson, T. Khimyak, J. S. McIndoe: Fragmentation of Transition Metal Carbonyl Cluster Anions: Structural Insights from Mass Spectrometry. In: Chemistry - A European Journal. 2003, 9 (4), doi:10.1002/chem.200390116, S. 944–950.
Kategorien:- Carbonylkomplex
- Stoffgruppe
Wikimedia Foundation.









![\mathrm{VCl_3\ +\ 4\ Na\ +\ 6\ CO\ +\ Diglyme\ \xrightarrow{(200\ bar, 433\ K, 48\ h)} \ Na(digly)_2[V(CO)_6]\ +\ 3\ NaCl}](9/5891d1b485cbdd37f618be7ed5ddf94e.png)
![\mathrm{[V(CO)_6]^-\ +\ H^+\ \xrightarrow \ H[V(CO)_6]\ \xrightarrow \ V(CO)_6\ +\ H_2}](9/a3911016b67de9dd8af98a0e307331f5.png)
![\mathrm{Co^{2+}\ +\ 1,5\ {S_2O_4^{2-}\ +\ 6\ OH^-\ +\ 4\ CO \xrightarrow \ [Co(CO)_4]^-\ +\ 3\ {SO_3}^{2-}\ +\ 3\ H_2O}}](3/0236c0f79e55d372aced7d2dd4172a08.png)


![\mathrm{Mn(CO)_5Cl\ +\ AlCl_3\ +\ CO\ \xrightarrow \ [Mn(CO)_6]^+\ [AlCl_4]^-}](3/f731311446a7dfd75b32d52403988950.png)



![\mathrm{Me(CO)_n \xrightarrow{{- CO}} \ [Me(CO)_{n-1}] \xrightarrow{{+ PPh_3}} \ Me(CO)_{n-1}PPh_3}](4/254b2b4305c95bb397d35c40e0b4bb7a.png)
![\mathrm{Me(CO)_n \xrightarrow{{+PPh_3}} \ [Me(CO)_nPPh_3] \xrightarrow{{- CO}} \ Me(CO)_{n-1}PPh_3}](b/73b9bfd2bd80cb262a1150c27cdad3a2.png)
![\mathrm{Mn_2(CO)_{10}\ +\ 2\ Na\ \longrightarrow \ 2\ Na[Mn(CO)_5]}](e/eeefbf0b8054f1e9f6eab6e6dfa52b36.png)
![\mathrm{(1)\ Fe(CO)_5\ +\ NaOH\ \longrightarrow \ Na[Fe(CO)_4COOH]\ \xrightarrow{{+ NaOH}} \ Na[HFe(CO)_4]\ +\ NaHCO_3}](1/b113b2aeb45c3788c4afb34505952ead.png)
![\mathrm{(2)\ Na[HFe(CO)_4]\ +\ NaOH\ \longrightarrow \ Na_2[Fe(CO)_4]\ +\ H_2O}](c/abcecad5274e1bfdd296fc66d3d7b947.png)
![\mathrm{ Na[HFe(CO)_4]\ +\ H^+\ \longrightarrow \ H_2[Fe(CO)_4]\ +\ Na^+ }](e/08e9df14b42095784253d0213b3d6f5f.png)
![\mathrm{Mn_2(CO)_{10}\ +\ Cl_2\ \longrightarrow \ 2\ [Mn(CO)_4Cl]\ +\ 2\ CO}](a/f3af6e3cb51c6b566e789af8f01c25ec.png)