- AsCl3
-
Strukturformel _svg.png)
Allgemeines Name Arsen(III)-chlorid Andere Namen Arsentrichlorid
Summenformel AsCl3 CAS-Nummer 7784-34-1 Kurzbeschreibung farblose, ölige, an der Luft rauchende Flüssigkeit Eigenschaften Molare Masse 181,2 g·mol−1 Aggregatzustand flüssig
Dichte 2,163 g·cm−3[1]
Schmelzpunkt −8,5 °C[1]
Siedepunkt 130,2 °C[1]
Dampfdruck 13 hPa[1] (20 °C)
Löslichkeit mit Wasser exotherme Reaktion[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23/25-50/53 S: (1/2)-20/21-28-45-60-61 MAK nicht festgelegt, da cancerogen[1]
LD50 48 mg·kg−3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Arsentrichlorid ist eine chemische Verbindung aus den Elementen Arsen und Chlor mit der Summenformel AsCl3. Es ist eine farblose, ölige Flüssigkeit, die an der Luft raucht.
Inhaltsverzeichnis
Gewinnung und Darstellung
Arsentrichlorid kann durch Verbrennung von Arsen in Chlorgas gewonnen werden:
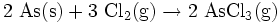
- Arsen verbrennt in Chlorgas zu Arsentrichlorid.
Als Ausgangsmaterial kann auch Arsen(III)-oxid dienen, über das wasserfreier Chlorwasserstoff bei 180–200 °C geleitet wird:
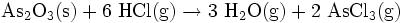
- Arsentrioxid reagiert mit Chlorwasserstoff zu Wasser und Arsentrichlorid.
Eine weitere Möglichkeit ist die Herstellung aus Arsentrioxid, Schwefeldichlorid und Chlor.[3]
Eigenschaften
Es zersetzt sich beim Erhitzen und unter Einfluss von Licht. Durch Luftfeuchtigkeit Bildung von korrosiven Dämpfen von Chlorwasserstoff und giftigem Arsen(III)-oxid. Reagiert heftig mit starken Oxidationsmitteln, Wasser, Basen.
Verwendung
Arsentrichlorid wird zum Beizen und Brünieren von Metallen verwendet.
Quellen
- ↑ a b c d e f g Sicherheitsdatenblatt (alfa-aesar)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Arsenverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 596.
Wikimedia Foundation.
