- Schwefeldichlorid
-
Strukturformel 
Allgemeines Name Schwefeldichlorid Andere Namen Schwefel(II)-chlorid
Summenformel SCl2 CAS-Nummer 10545-99-0 PubChem 25353 Kurzbeschreibung rot-braune Flüssigkeit mit stechendem Geruch [1]
Eigenschaften Molare Masse 102,97 g·mol−1 Aggregatzustand flüssig
Dichte 1,62 g·cm−3 (bei 15 °C)[1]
Schmelzpunkt Siedepunkt 59,5 °C[1]
Dampfdruck Löslichkeit reagiert mit Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 


Gefahr
H- und P-Sätze H: 314-335-400 EUH: 014 P: ? EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 14-34-37-50 S: (1/2)-26-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Schwefeldichlorid ist eine dunkelrote, toxische, hydrolyseempfindliche Flüssigkeit mit charakteristischem, an Chlor erinnernden Geruch.
Inhaltsverzeichnis
Geschichte
Eine der ersten Anwendungen von Schwefeldichlorid erfolgte 1846. Damals nutzte Alexander Parkes in Schwefelkohlenstoff (CS2) gelöstes Schwefeldichlorid zur Kaltvulkanisation von Kautschuk. Während des ersten Weltkrieges wurde Schwefeldichlorid zur Herstellung des Kampfstoffes S-Lost verwendet.
Gewinnung und Darstellung
Im Labor wird Schwefeldichlorid durch Umsetzung von Dischwefeldichlorid mit Chlorgas hergestellt. Ebenfalls möglich ist die direkte Umsetzung von Schwefel mit Chlor, wobei ein Gemisch aus Dischwefeldichlorid und Schwefeldichlorid erhalten wird. Eine Trennung der beiden Flüssigkeiten kann durch Destillation unter Schutzgasatmosphäre erfolgen. [3]
Eigenschaften
Physikalische Eigenschaften
Schwefeldichlord ist mit einer Bildungsenthalpie von -49 kJ/mol eine mäßig exotherme Verbindung. Sie ist bei Raumtemperatur nicht stabil und zerfällt in einer Gleichgewichtsreaktion zu Schwefelmonochlorid und Chlor. Eine Stabilisierung ist durch Zugabe von Phosphortrichlorid oder Phosphorpentachlorid möglich.
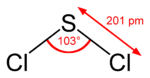
Schwefeldichlorid besitzt C2v-Symmetrie. Das Schwefelatom ist tetraedrisch von den beiden Chloratomen und von den beiden freien Elektronenpaaren umgeben. Der Bindungswinkel zwischen Cl-S-Cl beträgt etwa 103 Grad, die Bindungslänge d(Cl–S) = 2,01 Å.
Verwendung
Schwefeldichlorid kann als Sulfidierungs- und Chlorierungsmittel in der Synthese verwendet werden. Es reagiert mit ungesättigten Verbindungen wie Allylphenylethern oder Allylphenolen zu den entsprechenden Thiaheterocyclen bzw. Sulfonen.
Sicherheitshinweise
Da mit Schwefeldichlorid auf relativ einfache Weise die Darstellung von Senfgas möglich ist, werden Produktion, Verwendung und vor allem Ausfuhr gesetzlich geregelt und überwacht.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Schwefeldichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5.1.2008 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 10545-99-0 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 370-1.
Kategorien:- Ätzender Stoff
- Umweltgefährlicher Stoff
- Schwefelverbindung
- Chlorverbindung
Wikimedia Foundation.