- 4-Azaphenothiazin
-
Strukturformel 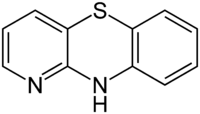
Allgemeines Name 4-Azaphenothiazin Andere Namen Pyridi[3,2-b][1,4]benzothiazin (IUPAC)
Summenformel C11H8N2S CAS-Nummer 261-96-1 Eigenschaften Molare Masse 200,26 g·mol−1 Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 4-Azaphenothiazin zählt in der Chemie zur Stoffgruppe der Heterocyclen und ist ein wichtiges Zwischenprodukt zur Synthese einer Vielzahl von Arzneistoffen.
Inhaltsverzeichnis
Geschichte
Die erstmalige Synthese gelang im Jahre 1958 durch eine Smiles-Umlagerung mit anschließender Cyclisierung.[3]
Gewinnung und Darstellung
Durch Schmelzen von N-(Pyrid-2-yl)-anilin mit Schwefel in Gegenwart katalytischer Mengen Iod wird 4-Azaphenothiazin erhalten.[1] Alternativ kann 4-Azaphenothiazin auch ausgehend von 2-Chlorpyridin und 2-Aminothiophenol hergestellt werden.[4]
Eigenschaften
An der sekundären Aminogruppe (NH) kann 4-Azaphenothiazin durch Umsetzung mit Halogenalkanen im basischen Medium alkyliert werden. Die Umsetzung von 4-Azaphenothiazin mit Phosgen liefert 4-Azaphenothiazin-10-carbonsäurechlorid, das mit Alkoholen zu Urethanen, mit Thiolen zu Thiocarbamidsäureestern und Aminen zu Harnstoffderivaten reagiert.[5]
Verwendung
4-Azaphenothiazin dient als Edukt für die Arzneistoffe Prothipendyl [Dominal® (D)], Isothipendyl [Andantol® (D)] und Pipazetat [Selvigon® (D)].[6]
Einzelnachweise
- ↑ a b W. Schuler, H. Klebe: 4-Azaphenothiazine und deren 10-Aminoalkyl-Derivate, in Liebigs Ann. 1962, 653, 172–180; doi:10.1002/jlac.19626530120.
- ↑ a b c Datenblatt 10H-PYRIDO(3,2-B)(1,4)BENZOTHIAZINE bei Sigma-Aldrich, abgerufen am 12. Mai 2011.
- ↑ H. L. Yale, F. Sowinski: 10-(Dialkylaminoalkyl)-pyrido[3,2-b][1,4]benzothiazine (1-Azaphenothiazine) and Related Compounds, in: J. Am. Chem. Soc. 1958, 80, 1651–1654; doi:10.1021/ja01540a035.
- ↑ B. Kutscher, H. R. Dieter, H.-G. Trömer, B. Bartz, J. Engel, A. Kleemann: Neue Synthese von 4-Azaphenothiazin, in: Liebigs Ann. 1995, 591–592; doi:DOI: 10.1002/jlac.199519950381.
- ↑ W. Schuler, H. Klebe, A. von Schlichtegroll: Derivate der 4-Azaphenothiazin-10-carbonsäure, in: Liebigs Ann. 1964, 673, 102–112; doi:10.1002/jlac.19646730114.
- ↑ A. von Schlichtegroll, in: Arzneimittel-Forschung 1957, 7, 237.
Wikimedia Foundation.
