- P2S5
-
Strukturformel 
Allgemeines Name Phosphor(V)-sulfid Andere Namen - Phosphorpentasulfid
- Tetraphosphordecasulfid
- fälschlich: Diphosphorpentasulfid
Summenformel P4S10 CAS-Nummer 1314-80-3 PubChem 14817 Kurzbeschreibung Gelbliches Pulver Eigenschaften Molare Masse 444,54 g·mol−1 Aggregatzustand fest
Dichte 2,08 g·cm−3[1]
Schmelzpunkt 288 °C[1]
Siedepunkt 514 °C[1]
Löslichkeit in Wasser Zersetzung[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Leicht-
entzündlichGesundheits-
schädlichUmwelt-
gefährlich(F) (Xn) (N) R- und S-Sätze R: 11-20/22-29-50 S: (2)-61 MAK 1 mg·m−3[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phosphor(V)-sulfid ist eine hygroskopische Chemikalie, die vorwiegend zur Synthese anderer Produkte verwendet wird. Sie kommt gewöhnlich als P4S10-Komplex vor.
Inhaltsverzeichnis
Darstellung
Phosphor(V)-sulfid wird durch Zusammenschmelzen der Elemente weißer Phosphor und Schwefel bei ca. 300°C gewonnen.[4]
Eigenschaften
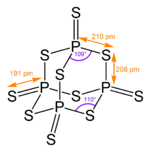 Die Struktur entspricht der von Phosphorpentoxid.
Die Struktur entspricht der von Phosphorpentoxid.Mit Wasser (auch Luftfeuchtigkeit) bildet Phosphor(V)-sulfid übelriechendes und in größeren Mengen giftiges H2S und Phosphorsäure. Phosphor(V)-sulfid ist in Kohlenstoffdisulfid gut löslich.[3]
Verwendung
Phosphor(V)-sulfid wird für die Synthese schwefel- und phosphorhaltiger organischer Substanzen verwendet, insbesondere Insektizide und Zinkdialkyldithiophosphate (Additive von Schmierstoffen). Phosphor(V)-sulfid kann auch zur Herstellung des Nervenkampfstoffs VX verwendet werden ("Dual Use"). Amide lassen sich durch Umsetzung mit Phosphor(V)-sulfid in Thionamide umwandeln:
Quellen
- ↑ a b c d Eintrag zu Phosphorpentasulfid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 28.11.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1314-80-3 im European chemical Substances Information System ESIS
- ↑ a b Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 788f.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 565-8.
Wikimedia Foundation.

