- Kohlenstoffdisulfid
-
Strukturformel 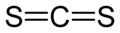
Allgemeines Name Kohlenstoffdisulfid Andere Namen Schwefelkohlenstoff
Summenformel CS2 CAS-Nummer 75-15-0 Kurzbeschreibung farblose, stark lichtbrechende Flüssigkeit, die im Reinzustand angenehm aromatisch, auf Grund von Verunreinigung jedoch meist unangenehm riecht[1]
Eigenschaften Molare Masse 76,14 g·mol−1 Aggregatzustand flüssig
Dichte 1,26 g·cm−3[2]
Schmelzpunkt Siedepunkt 46,3 °C[2]
Dampfdruck Löslichkeit - schlecht in Wasser[1]
- löslich in Diethylether, Benzol, Chloroform, Ethanol und Tetrachlormethan[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 225-361fd-372-319-315 EUH: keine EUH-Sätze P: 210-281-305+351+338-314 [4] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Leicht-
entzündlichGiftig (F) (T) R- und S-Sätze R: 11-36/38-48/23-62-63 S: (1/2)-16-33-36/37-45 MAK 16 mg·m−3[5]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kohlenstoffdisulfid (Trivialname: Schwefelkohlenstoff, CS2) ist ein Sulfid des Kohlenstoffs.
Inhaltsverzeichnis
Gewinnung und Darstellung
Kohlenstoffdisulfid besitzt eine positive Standardbildungsenthalpie (für flüssiges CS2: ΔHf = + 89,7 kJ/mol), die Synthese aus den Elementen ist damit eine endotherme Reaktion. Beim Zerfall in die Elemente Schwefel und Kohlenstoff kann die Verbindung den entsprechenden Energiebetrag wieder abgeben. Der Zerfall erfolgt jedoch nicht spontan, da es sich um eine metastabile Verbindung handelt. Die Synthese aus den Elementen erfolgte bis in die 50er Jahre unter Luftausschluss durch Überleitung von Schwefeldämpfen über glühende Holzkohle bei 800–1000 °C. Heutzutage wird Kohlenstoffdisulfid aus meist ungereinigtem Erdgas (oder anderen Quellen für Alkane) und Schwefel bei 600 °C in Gegenwart von Katalysatoren synthetisiert. Bei dieser Reaktion entsteht außerdem Schwefelwasserstoff, der industriell weiterverarbeitet wird.
Eigenschaften
Kohlenstoffdisulfid ist eine farblose, in reinem Zustand angenehm wie Ether, durch Verunreinigungen aber fast immer sehr unangenehm riechende, stark lichtbrechende und äußerst leicht entzündliche Flüssigkeit (Flp. -30°C); eine Zündtemperatur +102°C besagt, daß sich Dämpfe bereits an mäßig heißen Oberflächen entzünden können[6]. Schwefelkohlenstoff ist ein gutes Lösungsmittel unter anderem für Iod, Schwefel, Selen und weißen Phosphor.
CS2 verbrennt mit einer sehr niedrigen Temperatur (Flammentemperatur unter 200 °C).Toxikologie
Da Schwefelkohlenstoff gut fettlöslich ist, wird es über Lunge und Haut leicht aufgenommen. Eine längere Exposition führt zu Vergiftungserscheinungen: Die akute Schwefelkohlenstoffvergiftung äußert sich in Gesichtsrötung, euphorischen Erregungszuständen, dann Bewusstlosigkeit, Koma und Atemlähmung; die chronische Schwefelkohlenstoffvergiftung durch wiederholtes längeres Einatmen äußert sich in Kopfschmerzen, Schlaflosigkeit, Gedächtnis-, Seh- und Hörstörungen, Nervenentzündungen und Gefäßschäden.
Verwendung und Reaktionen
Schwefelkohlenstoff wird in großen Mengen zur Herstellung von Cellulosefasern aus Zellstoff eingesetzt, wobei der Zellstoff zuerst mit Natronlauge zu Alkalicellulose umgesetzt und diese nach dem oxidativem Abbau mit Schwefelkohlenstoff zu dem in Natronlauge löslichem Xanthogenat verarbeitet wird. Die so entstandene Celluloselösung, auch Viskose genannt, wird in schwefelsauren Spinnbädern zu Regeneratcellulose versponnen. Es ist ein Lösungsmittel für Fette und wird in der Infrarot-Spektroskopie eingesetzt, da es keine störenden Wasserstoff- oder Halogenbanden besitzt. Außerdem zeigt Schwefelkohlenstoff einen starken Kerr-Effekt und wird daher als Kerrlinse in Festkörperlasern eingesetzt. Die gelben Kupferxanthogenate geben unter Zersetzung giftigen Schwefelkohlenstoff frei und werden zur Schädlingsbekämpfung eingesetzt. Mit Ammoniak, primären und sekundären Aminen entstehen Dithiocarbamate.
Die Reduktion mit Natrium in Dimethylformamid ergibt das Dinatriumsalz von DMIT, Kurzbezeichnung für Dimercaptoisotrithion, einer Ausgangsverbindung zur Herstellung schwefelreicher Heterocyclen und von substituierten Tetrathiafulvalenen. Beim Kochen mit wässrigen Sulfid-Lösungen entstehen Trithiocarbonate. Bei der Reaktion mit Grignard-Verbindungen entstehen durch eine Insertionsreaktion Magnesiumsalze, deren Hydrolyse Dithiocarbonsäuren (R-CSSH) ergibt.
Spuren von Schwefelkohlenstoff (ca. 1 mg / L) werden dem Elektrolytbad bei der galvanischen Silberabscheidung als Glanzbildner hinzugegeben. Es verursacht einen sofortigen, vorübergehenden Abfall der kathodischen Polarisation. Dadurch ist es möglich, nahezu spiegelglänzende Silberschichten abzuscheiden.[7] Diese Wirkung als sogenannter Glanzbildner ist bereits seit Mitte des 19. Jahrhunderts bekannt.[8]
Kohlenstoffdisulfid hat die gleiche Brechzahl wie Glas, daher ist in Kohlenstoffdisulfid eingetauchtes Glas praktisch unsichtbar. Dies wird beispielsweise zum Erkennen von gefälschten Diamanten verwendet. Echte Diamanten bleiben, anders als Glas, auch beim Eintauchen gut sichtbar. Oftmals entsteht Schwefelkohlenstoff auch auf natürliche Art und Weise, zum Beispiel bei Fäulnisprozessen.
Historische Anwendung
Im letzten Viertel des 19. Jahrhunderts gab es mehrere erfolglose Versuche, Kohlenstoffdisulfid als Arbeitsflüssigkeit für Dampfmaschinen einzusetzen.[9] Schwefelkohlenstoff wurde auf Grund seiner hohen Toxizität auch zur Vernichtung von Ratten[10] und Wühlmäusen[11] eingesetzt. Die toxische Wirkung wurde 1866 beschrieben.[12] In Schwefelkohlenstoff gelöster weißer Phosphor wurde in Phosphorbomben verwendet.
Nachweis
Kohlenstoffdisulfid gibt mit Diethylamin in Gegenwart von Kupfersalzen (Cu2+) einen gelben Dithiocarbamat-Komplex:
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009..
- ↑ a b c d e Datenblatt Kohlenstoffdisulfid bei AlfaAesar, abgerufen am 9. Februar 2010 (JavaScript erforderlich)..
- ↑ a b Eintrag zu CAS-Nr. 75-15-0 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Carbon disulfide bei Sigma-Aldrich, abgerufen am 7. April 2011.
- ↑ Eintrag zu CAS-Nr. 75-15-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. Januar 2008 (JavaScript erforderlich).
- ↑ http://userpage.chemie.fu-berlin.de/~tlehmann/unterweisung/zuendtemperatur.html
- ↑ Neuzeitliche galvanische Metallabscheidung, 1953, Carl Hanser Verlag München.
- ↑ Pierer's Universal-Lexikon, Band 18. Altenburg 1864, S. 517-519.
- ↑ The Museum of RetroTechnology: Carbon Disulphide Engines.
- ↑ Meyers Großes Konversations-Lexikon, 6. Auflage, 1905–1909, Eintrag Ratten
- ↑ Meyers Großes Konversations-Lexikon, 6. Auflage, 1905–1909, Eintrag Wühlmaus
- ↑ S. Cloëz, Ueber die giftigen Eigenschaften des Schwefelkohlenstoffs und über die Anwendung dieser Flüssigkeit zur Vertilgung der Ratten und der in der Erde lebenden schädlichen Thiere, Polytechnisches Journal, LXIII, S. 185, Juli 1866. [1]
Kategorien:- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Feuergefährlicher Stoff
- Giftiger Stoff
- Kohlenstoffverbindung
- Schwefelverbindung
Wikimedia Foundation.

![\mathrm{[Cu^{II}{{(SC(S)N(C_2H_5)_2)}}_2]}](7/d5769c584778e0ca10c2e10cd25aad28.png)