- PFK
-
Phosphofructokinase Bezeichner Externe IDs CAS-Nummer: 9001-80-3 Enzymklassifikation EC, Kategorie 2.7.1.11 (Phospho-)Transferase Substrat ATP + D-Fructose-6-Phosphat Produkte ADP + D-Fructose-1,6-bisphosphat Phosphofructokinase (PFK, auch Fructose-6-phosphat-kinase genannt, EC2.7.1.11) ist der zentrale Schalter in der Glykolyse. Die verfügbare Energie der Zelle (ATP, Citrat, NADH/H+) bzw. des Organismus (Blutglucose) wird hier eingestellt.
- Das Enzym katalysiert den geschwindigkeitsbestimmenden Schritt („Flaschenhals“) im ersten Teil des Glucose-Stoffwechsels. Diese Schlüsselposition unterstützt die Rolle der PFK als Regulatorenzym.
- Man unterscheidet PFKI (Bildung des Metaboliten Fructose-1,6-bisphosphat (F-1,6-BP)) und PFKII (Bildung des wichtigen PFK-I-Effektors Fructose-2,6-bisphosphat (F-2,6-BP)), Enzyme, die zusammen auch die Signale der Hormone Glucagon und Insulin verarbeiten, und damit den Blutzucker regulieren.
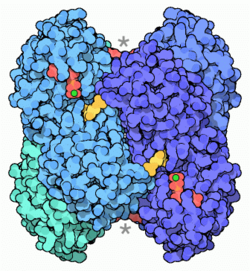
- Es katalysiert die Umwandlung von Fructose-6-phosphat zu F-1,6-BP bzw. F-2,6-BP unter ATP-Verbrauch (Abbildung).
Inhaltsverzeichnis
Stellung im Energiestoffwechsel
Die doppelte Rolle der Glykolyse besteht in der Sammlung von Bausteinen aus verschiedenen Abbauwegen ("Sammelphase") und der Gewinnung chemischer Energie in Form von ATP ("Gewinnphase"). Zur Erfüllung dieser Bedürfnisse muss der Glucoseumsatz an solchen Enzymen reguliert werden, die "irreversibel" arbeiten und spezifisch für die Glycolyse sind. Prinzipielle Kandidaten hierfür wären die Reaktionen der Phosphofructokinase (PFK) und der Pyruvatkinase (PK); die Hexokinasereaktion scheidet aus, da ihr Produkt, G-6-P ein multifunktioneller Metabolit ist. Als wichtigste Kontrollstelle gilt heute die Phosphofructokinase (PFK), die die (in der Zelle irreversible) Umwandlung von Fructose-6-phosphat in Fructose-1.6-bisphosphat bewerkstelligt. Das Leberenzym, ein 340 kDa Tetramer, wird durch höhere ATP-Konzentrationen inhibiert (Substratinhibition), d.h. die Michaeliskonstante (Km-Wert) des Substrates F-6-P wird erhöht (seine Bindungsstärke erniedrigt).
Diese Eigenschaften der PFKI bilden den wichtigsten Aspekt molekularer Erklärungen des Pasteur-Effektes, wonach bei Umschaltung auf aeroben Stoffwechsel der Metabolitenstrom in der Glycolyse gedrosselt wird, um einen gleich bleibenden Energiestatus der Zelle zu gewähren.
Regulatorfunktionen
Regulation in der Zelle
PFKI besitzt ihr katalytisches Zentrum am N-Terminus, das regulatorische Zentrum am C-Terminus eines durch Genduplikation entstandenen Fusionsproteins. Beide Hälften zeigen infolgedessen Sequenzhomologien, unterlagen aber, entsprechend ihrer Aufgabe, getrennten Optimierungsprozessen:
- der katalytische Teil bindet die Substrate Fructose-6-phosphat (F-6-P) und ATP;
- ATP nimmt bei höheren Konzentrationen auch einen (niederaffinen) Bindungsplatz am regulatorischen Teil ein und wirkt von dort aus als allosterischer Inhibitor ("Substratinhibition"). Eine Hemmfunktion teilt es mit weiteren endogenen Energieüberschusssignalen der Zelle (NADH/H+ und Citrat). Sind hingegen Energiemangelsignale (AMP, ADP) vorhanden, so wird das Enzym allosterisch aktiviert. Solange AMP und ADP vorherrschen, determinieren sie das Geschehen.
- In Erythrozyten wirkt das im Rapoport-Luebering-Zyklus durch das Enzym Bisphosphoglyceratmutase gebildete Intermediat 2,3-Diphosphoglycerat als ein Inhibitor der Phosphofructokinase.
Regulation im Organismus
Seit längerem ist bekannt, dass PFKI nicht nur durch eines seiner Substrate (ATP) inhibierbar ist, sondern auch durch eines seiner Produkte (F-1,6-BP) in vitro aktiviert werden kann ("verkehrtes Enzym"). In der Zelle tritt der letztere Effekt vermutlich nicht auf, da F-1,6-BP durch Aldolasetätigkeit nie die erforderliche Gleichgewichtskonzentration erreicht. Man fand jedoch, dass ein Isomeres, das Fructose-2,6-bisphosphat (F-2,6-BP), ein physiologischer allosterischer Aktivator ist. F-2,6-BP vermittelt Hungersignale (zu niedriger Blutzucker), die vom Organismus über Glucagon oder Adrenalin ausgesandt werden. Nach Art eines "dritten Messengers" dient es zur Fortpflanzung entlang der Signaltransduktionskette Glucagon - cAMP - PKA (vergl. "second messenger").
F-2,6-BP ist das Produkt einer weiteren, spezialisierten Phosphofructokinase (PFKII). Diese „PFKII“, in Vertebraten ein Fusionsprotein aus Phosphofructokinase und Fructose-2,6-Bisphosphatase, gehört zu den interkonvertierbaren Enzymen, d.h. ihre Aktivität wird durch Proteinkinase A (PKA) und damit indirekt durch hormonelle Signale reguliert: Phosphorylierung eines einzigen Serinrestes schaltet die Kinaseaktivität ab, während gleichzeitig die Phosphataseaktivität angeschaltet wird. Das von Glucagon ausgehende Signal bewirkt also, dass F-2,6-BP nicht mehr verfügbar ist. Hierdurch kommt der Metabolitenstrom der Glykolyse an der PFKI zum Erliegen. In der Leber wird der resultierende G-6-P Stau durch Überführung in Glucose abgebaut (bzw. die Glykolyse durch die Gluconeogenese umgekehrt), die als Neutralmolekül an den Blutkreislauf abgegeben werden kann. Das Glucagonsignal „zu geringer Blutzucker“ ist damit beantwortet.
Das gegenläufige (Insulin-) Signal "zu hoher Blutzucker" wird offenbar durch ein extrem pH-abhängiges Aktivitätsprofil realisiert. Als Antagonist des Glucagons hat das Insulin auch Wirkung auf die F-2,6-BP-Konzentration, indem über Aktivierung einer Phosphodiesterase der cAMP-Spiegel gesenkt und eine Phosphatase aktiviert wird. Diese dephosphoryliert die PFKII, sodass ihre Kinaseaktivität zum Tragen kommt und F-2,6-BP hergestellt wird, das aktivierend auf die PFKI und damit die Glykolyse wirkt. Damit wird die das Signal auslösende, überschüssige Blutglucose abgebaut. Dabei beinhaltet die Aktivierung der PFK1 nicht nur Konformationsänderungen der individuellen Untereinheiten, sondern auch Aggregatbildung zu höheren Oligomeren.
Im Skelettmuskel findet man ein Isoenzym der PFKII mit den gleichen Funktionalitäten, die aber reziprok reguliert werden. D.h. Glucagon stimuliert die Phosphofructokinase (durch Phosphorylierung mittels PKA) und damit über F-2,6-BP die Glykolyse zwecks Energiebereitstellung. Diese Umkehrung der Funktion bietet die Grundlage des Cori-Zyklus, über den bei Muskelaktivität unvollständig oxidiertes Lactat aus der Glykolyse über das Blut zur Leber gebracht wird, wo es (trotz gleicher hormoneller Situation) der Gluconeogenese zugeführt wird.
Phosphofructokinase in der Photosynthese
Bei der Photosynthese entsteht in Pflanzen durch Lichtenergie ATP und NADPH/H+ für Biosynthesen. Gleichzeitig entsteht durch Kohlendioxid-Fixierung (Assimilation) bei C3-Pflanzen 3-Phosphoglycerat (3-PG), ein Intermediat sowohl der Glycolyse als auch der Glucose-Biosynthese (Gluconeogenese). Bei Energieüberschuss ist der letztere Weg gefragt, der schließlich zum Energiespeicher Stärke führt. Verfügbarkeit von 3-PG reguliert (hemmt) PFKII, wodurch die Gluconeogenese ein- die Glycolyse aber ausgeschaltet wird.
- Energieüberschusssignale der Zelle (ATP, Citrat und NADH/H+ in tierischen, 3-PG in pflanzlichen Geweben) verhindern also allgemein die Bildung überflüssigen ATPs.
Siehe auch: Substratzyklus
Weblinks
Wikimedia Foundation.

.png)

