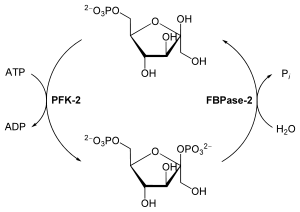
- Fructose-2,6-bisphosphat
-
Strukturformel 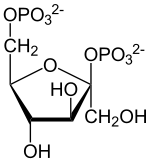
β-D-Fructose-2,6-bisphosphat Allgemeines Name Fructose-2,6-bisphosphat Andere Namen - F-2,6-BP
- Fructose-2,6-diphosphat
Summenformel C6H14O12P2 CAS-Nummer 79082-92-1 PubChem 105021 Eigenschaften Molare Masse 340,12 g·mol−1 Aggregatzustand fest
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fructose-2,6-bisphosphat (F-2,6-BP) ist ein zweifach phosphorylierter Zucker (Fructose), der in der Regulation der Glykolyse und Gluconeogenese eine wichtige Rolle spielt, indem er die Aktivität der Enzyme Phosphofructokinase (PFK1) und Fructose-1,6-bisphosphatase (FBPase1) allosterisch kontrolliert.[2]
Inhaltsverzeichnis
Bildung und Abbau
F-2,6-BP wird aus Fructose-6-phosphat gebildet, welches die Phosphofructokinase-2 (PFK-2) katalysiert. Dabei wird ATP verbraucht. Der Abbau von F-2,6-BP zu Fructose-6-phosphat und anorgansichem Phosphor katalysiert die Fructose-2,6-bisphosphatase (FBPase-2). PFK-2 und FBPase-2 haben zwar unterschiedliche enzymatische Aktivitäten, bilden aber zusammen ein bifunktionelles, hormonell regulierbares Enzym, die PFKFB.[3]
Wirkung im Glucosestoffwechsel
Bei hoher physiologischer Konzentration (im Bereich von >0,1 μM[4]) ist F-2,6-BP ein wirksamer allosterischer Aktivator der Phosphofructokinase 1. Es vermag zudem die blockierende Wirkung der allosterischen Hemmer ATP und Citrat aufzuheben. Dadurch wird die Schlüsselreaktion der Glykolyse, die stark exergone Phosphorylierung von Fructose-6-phosphat zu Fructose-1,6-bisphosphat (F-1,6-BP), aktiviert. Sie läuft ohne F-2,6-BP bei üblichen physiologischen Konzentrationen der Substrate fast nicht ab.[4] Durch die Aktivierung wird die gesamte Glycolyse stimuliert. Das Produkt F-1,6-BP ist nämlich ein Aktivator der Pyruvatkinase, welches eine Folgereaktion der Glykolyse katalysiert. Diesen Regulationsmechanismus nennt man feedforward-Stimulierung.[5]
Die Konkurrenzreaktion zur Glykolyse, die Gluconeogenese, wird von hohen F-2,6-BP-Konzentrationen dagegen wirksam unterdrückt, indem das Enzym Fructose-1,6-bisphosphatase allosterisch gehemmt wird. Durch diese reziproke Kontrolle wird verhindert, dass durch gleichzeitiges Ablaufen beider Stoffwechselwege Energie verschwendet wird.
Regulation der Konzentration
Ist der Blutzuckerspiegel niedrig, z. B. bei Nahrungskarenz, wird in der Bauchspeicheldrüse das Hormon Glucagon gebildet. In der Leber, dem Hauptorgan für die Gluconeogenese, löst Glucagon eine Signalkaskade aus, durch die die intrazelluläre cAMP-Konzentration erhöht wird. Dies aktiviert die cAMP-abhängige Proteinkinase A (PKA), welche die PFKFB phosphoryliert.[3]
Dadurch wird die PFK2-Funktion deaktiviert und die FBPase2 des bifunktionellen Enzyms aktiviert. Folglich sinkt die Konzentration an Fructose-2,6-bisphosphat, weil es durch FBPase2 zu Fructose-6-phosphat hydrolysiert wird. Das Gluconeogeneseenzym FBPase1 wird nicht mehr durch F-2,6-BP gehemmt und der Blutzucker steigt. Auch weil gleichzeitig die stimulierende Wirkung von F-2,6-BP auf die Glykolyse entfällt.
Umgekehrt entsteht bei hohem Glucosespiegel durch die ersten Schritte der Glycolyse viel Fructose-6-phosphat. Dieses wirkt als Aktivator der Phosphoproteinphosphatase, welches PFKFB dephosphoryliert. Dadurch wird die FBPase2-Aktivität ab- und die PFK2-Funktion angestellt und folglich vermehrt F-6-P zu F-2,6-BP phosphoryliert. Dies bewirkt eine Aktivierung der Glycolyse und Hemmung der Gluconeogenese und damit eine Senkung des Blutzuckers.
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Wu, C. et al. (2006): Roles for fructose-2,6-bisphosphate in the control of fuel metabolism: beyond its allosteric effects on glycolytic and gluconeogenic enzymes. In: Adv. Enzyme Regul 46(1); 72–88; PMID 16860376; doi:10.1016/j.advenzreg.2006.01.010
- ↑ a b Kurland, IJ. und Pilkis, SJ. (1995): Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme. In: Protein Sci. 4(6); 1023–1037; PMID 7549867; PMC 2143155.
- ↑ a b Hers, HG. und van Schaftingen, E. (1982): Fructose 2,6-bisphosphate 2 years after its discovery. In: Biochem J 206(1); 1–12; PMID 6289809; PMC 1158542.
- ↑ Bali, M. und Thomas, SR. (2001): A modelling study of feedforward activation in human erythrocyte glycolysis. In: C R Acad Sci III 324(3); 185–199; PMID 11291305; doi:10.1016/S0764-4469(00)01295-6
Literatur
- J. M. Berg, J. L. Tymoczko, L. Stryer: Stryer Biochemie. 6. Auflage. Spektrum Akademischer Verlag, München 2007, ISBN 978-3-8274-1800-5
- David L. Nelson und Michael M. Cox: Lehninger Principles of Biochemistry. Palgrave Macmillan; 5. Auflage 2008; ISBN 978-0-7167-7108-1; S. 587ff.
Wikimedia Foundation.