- PTAD
-
Strukturformel 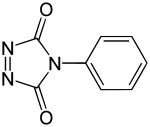
Allgemeines Name PTAD Andere Namen - 4-Phenyl-1,2,4-triazolin-3,5-dion
- 3,5-Dihydro-4-phenyl-4H-1,2,4-triazol-3,5-dion
Summenformel C8H5N3O2 CAS-Nummer 4233-33-4 PubChem 77913 Kurzbeschreibung roter Feststoff[1]
Eigenschaften Molare Masse 175,15 g·mol–1 Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 22-24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. PTAD (IUPAC-Name: 4-Phenyl-1,2,4-triazolin-3,5-dion) ist eine Azodicarbonylverbindung. Es wurde erstmals 1894 von Johannes Thiele und O. Stange durch Oxidation von 4-Phenylurazol mit Mennige in Schwefelsäure dargestellt. Für eine Charakterisierung reichte die dargestellte Substanzmenge jedoch nicht aus. Eine präparativ brauchbare Synthese wurde von R.C. Cookson erst 1971 veröffentlicht.
Inhaltsverzeichnis
Gewinnung/Darstellung
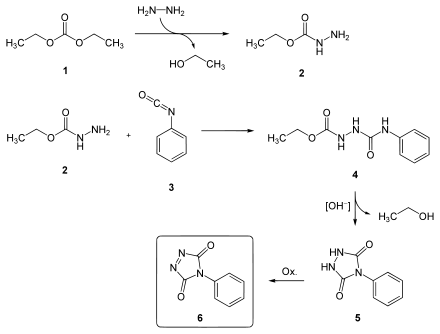
Die Synthese geht von Hydrazin und Diethylcarbonat (1) aus.[2] Diese reagieren zu Ethylhydrazincarboxylat (2), das mit Phenylisocyanat (3) umgesetzt wird. Das gebildete 4-Phenyl-1-carbethoxysemicarbazid (4) wird mit Base zum 4-Phenylurazol (5) cyclisiert, aus dem schließlich durch Oxidation das PTAD (6) gebildet wird.
Chemische Eigenschaften
PTAD ist nur stabil in Abwesenheit von Licht und Feuchtigkeit, bei Kontakt mit Alkalien tritt sofortige Zersetzung ein. Wasser, Alkohole und Säuren führen zu langsamer Zersetzung. Ein Schmelz- oder Siedepunkt kann nicht bestimmt werden, da sich die Verbindung zwischen 160 und 180 °C zersetzt, ohne zu schmelzen.
Zurzeit ist es das reaktivste bekannte Dienophil für Diels-Alder-Reaktionen. Es ist tausendmal reaktiver als Tetracyanoethen und sogar zweitausendmal reaktiver als Maleinsäureanhydrid. So erfolgen einfache Cycloadditionen bereits bei sehr niedrigen Temperaturen und selbst mit Cyclooctatetraen, das wegen seiner Wannenform kein geeignetes 1,3-Dien für eine Diels-Alder-Reaktion ist, kann es zum erwarteten Cycloaddukt reagieren. Es wird angenommen, dass die Reaktion in diesem Fall nicht konzertiert, sondern über ein Homotropylium-Zwitterion abläuft.[3]
Verwendung
Neben der Anwendung in Diels-Alder-Reaktion und anderen Cycloadditionen wird es wegen seiner hohen Reaktivität und Reaktionsgeschwindigkeit auch als Abfangreagenz für instabile Moleküle mit konjugierten Doppelbindungen eingesetzt. Mit PTAD gelang erstmals die Synthese des stark gespannten Prismans.
Quellen
Wikimedia Foundation.