- Cyclooctatetraen
-
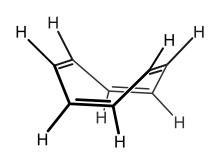
Strukturformel 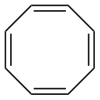
Allgemeines Name Cyclooctatetraen Andere Namen - COT
- Cycloocta-1,3,5,7-tetraen
- [8]Annulen
Summenformel C8H8 CAS-Nummer 629-20-9 PubChem 637866 Kurzbeschreibung gelbe Flüssigkeit mit unangenehmem Geruch[1]
Eigenschaften Molare Masse 104,15 g·mol−1 Aggregatzustand flüssig
Dichte 0,93 g·cm−3[1]
Schmelzpunkt Siedepunkt 142–143 °C [1]
Dampfdruck Löslichkeit unlöslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 


Gefahr
H- und P-Sätze H: 225-304-315-319-335 EUH: keine EUH-Sätze P: 210-261-301+310-305+351+338-331 [3] EU-Gefahrstoffkennzeichnung [1] 
Leicht-
entzündlich(F) R- und S-Sätze R: 11 S: 26-37-60 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cyclooctatetraen (COT) ist eine organisch-chemische Verbindung aus der Gruppe der cyclischen Kohlenwasserstoffe. Die Verbindung mit der Summenformel C8H8 besitzt vier konjugierte C=C-Doppelbindungen.
Im Gegensatz zu Benzol (C6H6) zählt COT nicht zu den aromatischen Kohlenwasserstoffen, da es aufgrund der Anzahl seiner π-Elektronen nicht der Hückel-Regel entspricht und auch nicht planar ist, sondern Wannenform besitzt. Somit ist Cyclooctatetraen weder ein Aromat, noch ein Antiaromat.[4] Durch die fehlende aromatische Stabilisierung ist es eher den gewöhnlichen Polyenen vergleichbar, allerdings aufgrund der durch die Ringspannung verursachten Bindungswinkeldeformation von erhöhter Reaktivität.
Das wannenförmige COT-Molekül kann als Chelatligand – ähnlich wie 1,5-Cyclooctadien (COD) – Metallkomplexe bilden. Durch die Aufnahme von zwei Elektronen, z. B. durch Übertragung von einem Metall, wird aus dem COT mit acht π-Elektronen das planare, aromatische Cyclooctatetraenyl-Anion C8H82−. Dieser Aromat entspricht mit zehn π-Elektronen der Hückel-Regel. Ein bekanntes Beispiel für einen Komplex mit planaren Cyclooctatetraenyl-Liganden ist das Uranocen.
Darstellung
COT wurde erstmals 1905 von Richard Willstätter synthetisiert.[5]
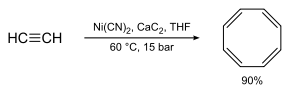
COT kann durch Cyclotetramerisierung nach Reppe aus Ethin hergestellt werden:[6]
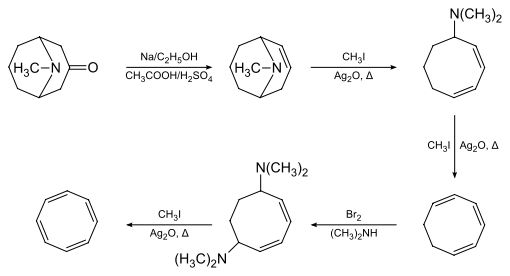
Eine andere Synthese geht vom Cuban aus. In Gegenwart von Rhodiumkatalysatoren wird zunächst das syn-Tricyclooctadien gebildet, welches anschließend thermisch bei 50–60 °C zum Cyclooctatetraen umgewandelt werden kann.[7]
Einzelnachweise
- ↑ a b c d e Datenblatt Cyclooctatetraen bei AlfaAesar, abgerufen am 7. Januar 2008 (JavaScript erforderlich).
- ↑ a b Datenblatt Cyclooctatetraen bei Acros, abgerufen am 19. Februar 2010.
- ↑ a b Datenblatt Cyclooctatetraene bei Sigma-Aldrich, abgerufen am 23. März 2011.
- ↑ Frank-Gerrit Klärner: Wie antiaromatisch ist planares Cyclooctatetraen?. In: Angewandte Chemie. 113, Nr. 21, 2001, S. 4099–4103, doi:10.1002/1521-3757(20011105)113:21<4099::AID-ANGE4099>3.0.CO;2-1.
- ↑ Richard Willstätter, Ernst Waser: Über Cyclo-octatetraen. In: Berichte der deutschen chemischen Gesellschaft. 44, Nr. 3, 1911, S. 3423–3445, doi:10.1002/cber.191104403216.
- ↑ Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel: Cyclisierende Polymerisation von Acetylen I. Über Cyclooctatetraen. In: Justus Liebigs Annalen der Chemie. 560, Nr. 1, 1948, S. 1–92, doi:10.1002/jlac.19485600102.
- ↑ L. Cessar, P.E. Eaton, J. Halpern: Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane, In J. Am. Chem. Soc. 92, 1972, S.3515-3518. doi:10.1021/ja00714a075.
Wikimedia Foundation.