- 4-Nitrotoluol
-
Nitrotoluole Name 2-Nitrotoluol 3-Nitrotoluol 4-Nitrotoluol Andere Namen o-Nitrotoluol,
2-Nitro-1-methylbenzol,
ONT, 2-NTm-Nitrotoluol,
3-Nitro-1-methylbenzol
p-Nitrotoluol,
4-Nitro-1-methylbenzol
Strukturformel 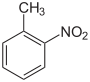
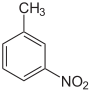

CAS-Nummer 88-72-2 99-08-1 99-99-0 PubChem 6944 7422 7473 Summenformel C7H7NO2 Molare Masse 137,14 g·mol−1 Aggregatzustand flüssig fest Kurzbeschreibung gelbe aromatisch bittermandelartig riechende Flüssigkeiten kristalliner Feststoff Schmelzpunkt -4,1 °C[1] 16,1 °C[2] 52 °C[3] Siedepunkt 222 °C[1] 232 °C[2] 238 °C[3] Löslichkeit praktisch unlöslich in Wasser, löslich in Aceton, Benzol, Ethanol, Ether und Chloroform Gefahrstoff-
kennzeichnung
[1][2][3]

Giftig Umwelt-
gefährlich(T) (N) 
Giftig (T) 

Giftig Umwelt-
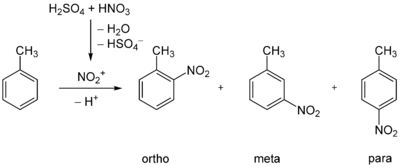
gefährlich(T) (N) R-Sätze 45-46-22-62-51/53 23/24/25-33 23/24/25-33-51/53 S-Sätze 53-45-61 28-36/37-45 (1/2)-28-37-45-61 WGK 3[1] 2[2] 2[3] Die Nitrotoluole sind aromatische Verbindungen mit einer Methylgruppe (–CH3) und einer Nitrogruppe (–NO2) als Substituenten am Benzolring. Durch unterschiedliche Anordnung der Substituenten ergeben sich drei Konstitutionsisomere. Das Stoffgemisch entsteht bei der Nitrierung von Toluol, wobei der Anteil des 3-Nitrotoluols aufgrund der dirigierenden Eigenschaften der Methylgruppe jedoch gering ist. Nitrotoluole treten als Zwischenprodukte bei der TNT-Herstellung auf und können dementsprechend häufig als Rüstungsaltlast im Boden und Grundwasser nachgewiesen werden.
Inhaltsverzeichnis
Darstellung
Bei der elektrophilen aromatischen Substitution von Toluol mit Salpetersäure ist der +I-Effekt der Methylgruppe für die Direktion des Zweitsubstituenten ausschlaggebend. Als Hauptprodukte entstehen 2-Nitrotoluol (ortho) mit 65 % und 4-Nitrotoluol (para) mit 30 %, 3-Nitrotoluol (meta) dagegen nur zu 5 %.[4]
Das 3-Nitrotoluol ist aus 3-Nitro-4-aminotoluol zugänglich, indem man die Aminogruppe diazotiert und das entstandene Diazoniumsalz reduktiv mit Ethanol umsetzt (Dediazonierung).[5]
Eigenschaften
Die Siedepunkte der drei Isomere liegen nah beieinander, während ihre Schmelzpunkte sich deutlich unterscheiden. Das 4-Nitrotoluol, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Verwendung
Die Nitrotoluole sind Zwischenprodukte bei der Herstellung von Toluidinen, bei der organischen Synthese von Pestiziden, Arznei-, Farb- und Kunststoffen. 2- und 4-Nitrotoluol sind Zwischenprodukte bei der TNT-Herstellung, sie werden zunächst zu 2,4-Dinitrotoluol weiternitriert. Man findet sie in Gesteins- und Bergbausprengstoffen.[6] 2-Nitrotoluol wird außerdem Plastiksprengstoffen als Markierungsstoff zugesetzt.
Generell sind die Nitrobenzoesäuren aus den Nitrotoluolen durch Oxidation der Methylgruppe zugänglich. So wird z. B. 4-Nitrotoluol durch Natriumdichromat in Gegenwart von konzentrierter Schwefelsäure zur 4-Nitrobenzoesäure oxidiert.[7]
Sicherheitshinweise
Die Nitrotoluole können explosive Dämpfe bilden, greifen Gummi und Kunststoffe an und sind krebserregend.
Einzelnachweise
- ↑ a b c d Eintrag zu 2-Nitrotoluol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 1. März 2008 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu 3-Nitrotoluol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 1. März 2008 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu 4-Nitrotoluol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 1. März 2008 (JavaScript erforderlich).
- ↑ Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 456.
- ↑ Organic Syntheses, Coll. Vol. 1, p. 415 (1941).
- ↑ http://www.umwelt.sachsen.de/lfug/Salfaweb/salfaweb-nt/berichte/FuE_Stv/Stv-2-Nitrot.html.
- ↑ Organic Syntheses, Coll. Vol. 1, p. 392 (1941).
Weblinks
Wikimedia Foundation.