- Nitrobenzoesäuren
-
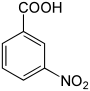
Nitrobenzoesäuren Name 2-Nitrobenzoesäure 3-Nitrobenzoesäure 4-Nitrobenzoesäure Andere Namen o-Nitrobenzoesäure m-Nitrobenzoesäure p-Nitrobenzoesäure Strukturformel 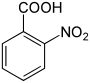
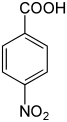
CAS-Nummer 552-16-9 121-92-6 62-23-7 PubChem 11087 8497 6108 Summenformel C7H5NO4 Molare Masse 167,12 g·mol−1 Aggregatzustand fest Kurzbeschreibung weißes kristallines
Pulvergelbliches kristallines
Pulvergelbliches kristallines
PulverSchmelzpunkt 146–148 °C[1] 140 °C[2] 240 °C[3] Siedepunkt Zers.[1] Zers.[2] Zers.[3] pKs-Wert 2,22[4] 3,44[4] 3,42[5] Löslichkeit 7,8 g/l (20 °C)[1] 3 g/l (25 °C)[2] 0,02 g/l (15 °C)[3] GHS-
Einstufung
[6][7][8]
Achtung
Achtung
Gefahr

H- und P-Sätze 315-319-335 302-315-319-335-412 302-318 keine EUH-Sätze keine EUH-Sätze keine EUH-Sätze 261-305+351+338 261-273-305+351+338 280-305+351+338 Gefahrstoff-
kennzeichnung
[1][2][3]
Reizend (Xi) 
Gesundheits-
schädlich(Xn) 
Gesundheits-
schädlich(Xn) R-Sätze 36/37/38 20/22-36/37 20/22-36/37 S-Sätze 26 24 22-26 Die Nitrobenzoesäuren bilden in der Chemie eine Stoffgruppe, die sich sowohl von der Benzoesäure als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Carboxy- (–COOH) und Nitrogruppe (–NO2) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C7H5NO4. Die 4-Nitrobenzoesäure findet vor allem Verwendung in der Analyse organischer Substanzen.
Inhaltsverzeichnis
Darstellung
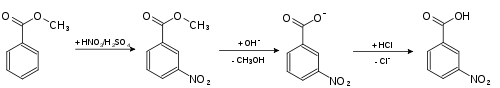
3-Nitrobenzoesäure erhält man aus Benzoesäuremethylester durch Umsetzung mit rauchender Salpetersäure in Gegenwart von konzentrierter Schwefelsäure.[9] Nach der Nitrierung wird der entstandene Ester zur Säure verseift.[10]
Wird jedoch die Benzoesäure direkt nitriert, so entsteht zumeist 3,5-Dinitrobenzoesäure.
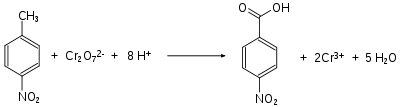
Generell sind die Nitrobenzoesäuren aus den Nitrotoluolen durch Oxidation der Methylgruppe zugänglich. So wird 4-Nitrotoluol mit Natriumdichromat in Gegenwart von konzentrierter Schwefelsäure zur 4-Nitrobenzoesäure oxidiert.[11]
Eigenschaften
Die Nitrobenzoesäuren sind farblose bis gelbliche kristalline Feststoffe. Die Schmelzpunkte unterscheiden sich deutlich. Die 4-Nitrobenzoesäure, die die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Die Nitrobenzoesäuren weisen aufgrund des −M-Effekts der Nitrogruppe eine höhere Acidität im Vergleich zur Benzoesäure auf. Die pKs-Werte sind daher entsprechend niedriger (Benzoesäure: 4,20[4]).
Verwendung
Analytik
Die 4-Nitrobenzoesäure findet vor allem Verwendung in der Analyse organischer Substanzen durch Derivatisierung. Flüssige Substanzen oder solche mit niedrigem Schmelzpunkt werden dazu in leicht kristallisierende Derivate umgewandelt: Alkohole können beispielsweise durch die Messung der Schmelzpunkte ihrer Ester der 4-Nitrobenzoesäure oder der 3,5-Dinitrobenzoesäure identifiziert werden. Hierzu wird die zu analysierende Substanz mit 4-Nitrobenzoesäure in Gegenwart geringer Mengen Schwefelsäure umgesetzt.
-
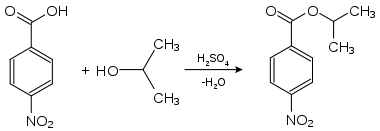 Nachweis von Isopropanol als Derivat der 4-Nitrobenzoesäure:
Nachweis von Isopropanol als Derivat der 4-Nitrobenzoesäure:
4-Nitrobenzoesäure-2-propylester (Smp.: 100,5 °C[4]).
Die Schmelzpunkte dieser Derivate sind in der Regel scharf. Diese Umsetzung ist auch für zahlreiche Amine geeignet.
Die Derivate der 3,5-Dinitrobenzoesäure besitzen in der Regel höhere Schmelzpunkte als die der 4-Nitrobenzoesäure.[4] Sie werden dann bevorzugt gewählt, wenn der Schmelzpunkt mit der 4-Nitrobenzoesäure zu niedrig ist und keine genaue Bestimmung mehr möglich wird.
Ist die fragliche Substanz empfindlicher, so erfolgt stattdessen die direkte Umsetzung mit dem entsprechenden Säurechlorid, dem 4-Nitrobenzoylchlorid. Auf diese Weise sind z. B. auch Derivate der Aminosäuren zugänglich.
Synthese
3-Aminobenzoesäure kann durch die Reduktion von 3-Nitrobenzoesäure erhalten werden. Als Reduktionsmittel eignen sich beispielsweise elementares Zink in Salzsäure[12] oder Hydrazin[13].
Einzelnachweise
- ↑ a b c d Eintrag zu 2-Nitrobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2009 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu 3-Nitrobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2009 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu 4-Nitrobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2009 (JavaScript erforderlich).
- ↑ a b c d e CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 511.
- ↑ Datenblatt 2-Nitrobenzoic acid bei Sigma-Aldrich, abgerufen am 4. Mai 2011.
- ↑ Datenblatt 3-Nitrobenzoic acid bei Sigma-Aldrich, abgerufen am 4. Mai 2011.
- ↑ Datenblatt 4-Nitrobenzoic acid bei Sigma-Aldrich, abgerufen am 4. Mai 2011.
- ↑ Oliver Kamm, J. B. Segur: Methyl m-nitrobenzoate. In: Organic Syntheses. Coll. Vol. 1, p. 372 (1941); PDF.
- ↑ Oliver Kamm, J. B. Segur: m-Nitrobenzoic acid. In: Organic Syntheses. Coll. Vol. 1, p. 391 (1941); PDF.
- ↑ O. Kamm, A. O. Matthews: p-Nitrobenzoic acid. In: Organic Syntheses. Coll. Vol. 1, p. 392 (1941); PDF.
- ↑ J. Wilbrand, F. K. Beilstein: Ueber eine neue Reihe isomerer Verbindungen der Benzoëgruppe. – Nitrodracylsäure und deren Derivate, in: J. Liebigs Ann. Chem., 1863, 128, S. 257–273; doi:10.1002/jlac.18631280302.
- ↑ T. Curtius: Die Einwirkung von Hydrazinhydrat auf Nitroverbindungen. I. Abhandlung, in: J. Prakt. Chem., 1907, 76, S. 233–237; doi:10.1002/prac.19070760116.
Siehe auch
-
Wikimedia Foundation.