- Pentine
-
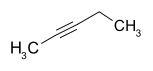
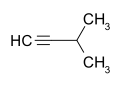
Pentine Name 1-Pentin 2-Pentin 3-Methyl-1-butin Andere Namen Propylacetylen 1-Methyl-2-ethylacetylen Isopropylacetylen, Isopentin Strukturformel 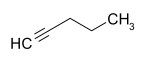
CAS-Nummer 627-19-0 627-21-4 598-23-2 PubChem 12309 12310 69019 Summenformel C5H8 Molare Masse 68,12 g·mol−1 Aggregatzustand flüssig Kurzbeschreibung farblose Flüssigkeit Schmelzpunkt −106 °C[1] −109 °C[2] −90 °C[3] Siedepunkt 39–41 °C[1] 55–57 °C[2] 29,5 °C[4] Dichte 0,69 g·cm−3[1] 0,71 g·cm−3[2] 0,666 g·cm−3 (20 °C)[3] Löslichkeit 1,05 g·l−1 in Wasser[1] unlöslich in Wasser[2] ? GHS-
Einstufung
Gefahr
Gefahr

keine Einstufung verfügbar H- und P-Sätze 225 225-315-319-335 siehe oben keine EUH-Sätze keine EUH-Sätze siehe oben 210-223-403+235 210-302+352-304+340-305+351+338-403+235 siehe oben Gefahrstoff-
kennzeichnung
[1][2][4]
Leicht-
entzündlich(F) 

Leicht-
entzündlichReizend (F) (Xi) 

Hoch-
entzündlichReizend (F+) (Xi) R-Sätze 11 11-36/37/38 12-36/37/38 S-Sätze 16-29 ? Die Pentine bilden in der Chemie eine Gruppe ungesättigter aliphatischer Kohlenwasserstoffe mit der allgemeinen Summenformel C5H8 und einer C–C-Dreifachbindung. Sie zählen damit zu den Alkinen.
Es gibt drei Isomere des Pentins:
- 1-Pentin
- 2-Pentin
- 3-Methyl-1-butin
Alle drei Isomere sind unter Normalbedingungen leichtflüchtige, brennbare Flüssigkeiten und in Wasser nahezu unlöslich. Die Isomere sind infolge ihrer C–C-Dreifachbindung wie die meisten Alkine sehr reaktionsfreudig und können z. B. leicht polymerisieren oder Additionsreaktionen eingehen.
Herstellung und Gewinnung
Bei der Herstellung der Pentine kann von den entsprechenden Alkenverbindungen ausgegangen werden, die zunächst durch Addition von Brom in die entsprechenden vicinalen Dibromide überführt werden. Eine Dehydrohalogenierung unter basischen Bedingungen führt zu den entsprechenden Pentinen. Für die Synthese von 1-Pentin wird vom 1-Penten ausgegangen. Das Dibromid als Zwischenverbindung wird in Gegenwart von Kaliumcarbonat bei hohen Temperaturen dehydrohalogeniert.[5] In ähnlicher Weise gelingt die Herstellung von 2-Pentin, wo die Dehydrohalogenierung in alkoholischer Kalilauge erfolgt.[6] Die Synthese von 3-Methyl-1-butin geht vom 3-Methyl-1-buten aus, welches zunächst bei -60°C bromiert wird. Das resultierende Dibromid wird in flüssigem Ammoniak mittels Natriumamid dehydrohalogeniert.[3]
Einzelnachweise
- ↑ a b c d e f Datenblatt 1-Pentin bei Merck, abgerufen am 21. Februar 2010.
- ↑ a b c d e f Datenblatt 2-Pentin bei Merck, abgerufen am 21. Februar 2010.
- ↑ a b c Miller H.N.; Greenlee, K.W.; Derfer, J.M.; Boord, C.E.: Mono- and Di-Alkylacetylenes from Vicinal Dihalides and Sodium Amide in Liquid Ammonia in J. Org. Chem. 19 (1954) 1882–1888. doi:10.1021/jo01377a003
- ↑ a b Datenblatt 3-Methyl-1-butin bei Acros, abgerufen am 21. Februar 2010.
- ↑ Guest H.H.: Rearrangements of the Triple Bond in J. Am. Chem. Soc. 50 (1928) 1744–1746. doi:10.1021/ja01393a036.
- ↑ Sherrill, M.L.; Matlack, E.S.: Additional Data on the cis and trans Isomers of Pentene-2 in J. Am. Chem. Soc. 59 (1937) 2134–2138, doi:10.1021/ja01290a014.
Wikimedia Foundation.
