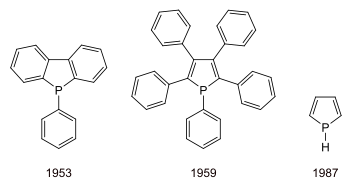- Phosphol
-
Strukturformel 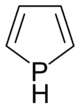
Allgemeines Name Phosphol Andere Namen 1H-Phosphol
Summenformel C4H5P CAS-Nummer 288-01-7 Eigenschaften Molare Masse 84,06 g·mol−1 Aggregatzustand flüssig
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phosphol ist eine organische Verbindung mit der Summenformel C4H5P; es handelt sich dabei um die phosphoranaloge Variante von Pyrrol.
Inhaltsverzeichnis
Geschichte
Erstmalig wurde ein Phospholderivat 1953 entdeckt, Pentaphenylphosphol folgte 1959. Die Synthese der Titelverbindung wurde 1987 beschrieben.[2]
Darstellung
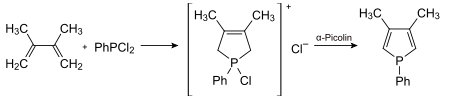
Allgemein werden Phosphole mittels McCormack-Reaktion[3] aus Butadienen und Dichlorphosphanen dargestellt.
Im gezeigten Beispiel kann der Phenylring anschließend mit Butyllithium abspalten werden.
Eigenschaften
Im Gegensatz zu anderen Fünfringheterozyklen wie Pyrrol, Thiophen und Furan weist Phosphol keine Aromatizität auf, da der Phosphor sein freies Elektronenpaar nicht den π-Elektronenpaaren innerhalb des Ringes zwecks Delokalisierung zur Verfügung stellt.
Die mit im obigen Abschnitt erläuterter Darstellung erhaltenen Phospholidanionen dimerisieren bei Protonierung. Diese Dimerisierung lässt sich durch Erhitzen rückgängig machen und man erhält das thermodynamisch stabilere exo-Dimer in Analogie zu Cyclopentadienen.
Die Charakterisierung des Phosphols kann wegen der Dimerisierung nur bei tiefen Temperaturen mittels 31P{1H}-NMR erfolgen.[4] Die chemische Verschiebung liegt für das Anion bei +76,6ppm, für das Phosphol bei −49,2ppm mit einer 1JPH Kopplungskonstanten von 234 Hz in THF.
Weitere physikalische Daten wie Siedepunkt, Schmelzpunkt, etc. oder toxikologische Eigenschaften sind daher nicht bekannt.
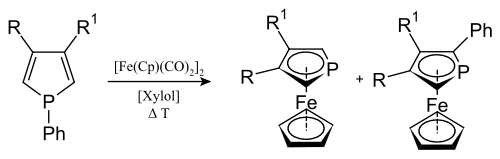
Übergangsmetallkomplexe
In Analogie zu anderen Metallocenen kann man aus Phospholen Phosphaferrocene herstellen.[5]Vom Phospholylligand (phosphacyclopentadienyl) und dessen Derivaten sind viele andere Übergangsmetallkomplexe bekannt.[6][7] Die Liganden (L) treten hierbei als 2, 3, 4, 5 oder in anionischer Form auch als 6-Elektronendonatoren auf, von völliger Lokalisation der Ring-π-Elektronen bei endständigen Komplexen wie L-M(CO)n zum Beispiel [(CO)5W(PC4H2Me2){η5-W(CO)5}][8] über metallverbrückte 3-Elektronenliganden (µ-L)M2(CO)8 zum Beispiel (µ-PC4H2Me2)Mn2(CO)8[9] bis zu völliger Delokalisation als η5-Ligand in η5-(Me2C4H2P)W(CO)3I[10] oder im Phosphaferrocen.
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ P. J. Fagan, W. A. Nugent: 1-Phenyl-2,3,4,5-tetramethylphosphole, in Org. Synth., 1992, 70, 272. 1-Phenyl-2,3,4,5-Tetramethylphosphole Volltext
- ↑ W. B. McCormack: U.S. Pat. 2.663.736 und 2.663.737. Volltext
- ↑ C. Charrier, H. Bonnard, G. de Lauzon, F. Mathey: Proton [1,5] shifts in P-unsubstituted 1H-phospholes. Synthesis and chemistry of 2H-phosphole dimers, in: J. Am. Chem. Soc., 1983, 105, 6871–6877; doi:10.1021/ja00361a022.
- ↑ F. Mathey, A. Mitschler, R. Weiss: Phosphaferrocene, in: J. Am. Chem. Soc., 1977, 99, 3537–3538; doi:10.1021/ja00452a076.
- ↑ E. W. Abel, N. Clark, C. Towers: η-Tetraphenylphospholyl and η-tetraphenylarsolyl derivatives of manganese, rhenium, and iron, in: J. Chem. Soc., Dalton Trans., 1979, 1552–1556; doi:10.1039/DT9790001552.
- ↑ S. Holand, F. Mathey, J. Fischer, A. Mitschler: Preparation of 3,3',4,4'-tetramethyl-1,1'-biphospholyl and its reactions with iron and cobalt carbonyls, in: Organomet., 1983, 2, 1234–1238; doi:10.1021/om50003a027.
- ↑ S. Holand, C. Charrier, F. Mathey, J. Fischer, A. Mitschler: Stabilization of 2H-phospholes by complexation. A phosphorus-carbon double bond acting as a four-electron donor, in: J. Am. Chem. Soc., 1984, 106, 826–828; doi:10.1021/ja00315a081.
- ↑ U. Flörke, O. Krampe, H.-J. Haupt: Bis(µ-3,4-dimethylphosphol-1-yl)bis(tetracarbonylmanganese), in: Act. Cryst. C, 1998, 54, 918–920; doi:10.1107/S0108270198001036.
- ↑ S. Holand, F. Mathey, J. Fischer: Synthesis and x-ray crystal structure analysis of (η5-3-4-dimethylphospholyl)tricarbonyl-iodotungsten, in: Polyhedron, 1986, 5, 1413–1421; doi:10.1016/S0277-5387(00)83502-0.
Weiterführende Literatur
- Louis D. Quin: A Guide to Organophosphorus Chemistry. John Wiley & Sons, 2000, ISBN 0-471-31824-8.
Wikimedia Foundation.