- Pyruvatkinasemangel
-
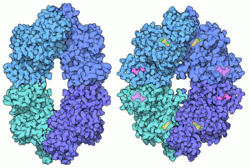
Pyruvatkinase Kalottenmodelle von Pyruvatkinasen. Links von E. coli (inaktiv) nach PDB 1E0U. Rechts von der Backhefe (aktiviert) nach PDB 1A3W. Größe 543/574/530/530 Aminosäuren Struktur Homotetramer Kofaktor Magnesium, Kalium Isoformen L, R, M1, M2 Bezeichner Gen-Namen PKLR; PKM2 Externe IDs OMIM: 609712 UniProt: P30613 179050 Enzymklassifikation EC, Kategorie 2.7.1.40 Kinase Reaktionsart Übertragung einer Phosphatgruppe Substrat ADP + Phosphoenolpyruvat Produkte ATP + Pyruvat Pyruvatkinase (Pk) heißt das Enzym, das eine Phosphatgruppe auf ADP überträgt und so die bei der Glykolyse gewonnene Energie als ATP bereitstellt. Sie ist daher unentbehrlich im Stoffwechsel aller Lebewesen. Während Bakterien zwei Isoformen des Enzyms besitzen, sind es bei den Wirbeltieren vier, wobei je zwei von einem Gen kodiert werden. Beim Menschen heißen diese Gene PKLR und PKM2. Mutationen im PKLR-Gen können hämolytische Anämie verursachen.[1]
Die vier Isoformen sind in verschiedenen Gewebetypen lokalisiert: L als das Haupt-Isozym in der Leber; R in Erythrozyten; M1 in Muskeln, Herz und Gehirn; und M2 im Fötus.[1]
Inhaltsverzeichnis
Katalysiertes Gleichgewicht
Durch die Katalyse wird vom Phosphoenolpyruvat eine Phosphatgruppe auf ADP übertragen. Es entstehen ATP und Pyruvat. Letzteres wird im Citratzyklus weiter abgebaut.
Struktur
Die Pyruvatkinase des Menschen ist ein Tetramer, bestehend aus vier identischen Protein-Untereinheiten mit je 528 Aminosäuren. In Säugetieren gibt es zwei Isoformen des Enzyms, das M-Isozym, welches insbesondere im Muskel und Gehirn vorkommt, und das L-Isozym, welches sich ausschließlich in der Leber findet.
Regulation der Pyruvatkinase
Beide Formen der Pyruvatkinase werden durch Fructose-1,6-bisphosphat aktiviert. Fructose-1,6-bisphosphat entsteht bei der dritten Reaktion der Glykolyse, welche durch Phosphofructokinase katalysiert wird. Diese Reaktion, der sog. committed step, bestimmt durch ihr Reaktionsprodukt, das Fructose-1,6-bisphosphat, welches als Aktivator für die nächste und letzte Reaktion der Glykolyse agiert, die Reaktionsgeschwindigkeit der Glykolyse. Diese Regulation ermöglicht eine Homöostase der Intermediärprodukte der Glykolyse.
Durch eine hohe Energieladung in der Zelle (hohe ATP-Konzentration) und die Anwesenheit von Alanin wird die Pyruvatkinase inhibiert. Somit läuft die Reaktion nicht ab, wenn keine weitere Energie von der Zelle benötigt wird.
Das L-Isozym wird zusätzlich durch Proteinphosphorylierung kontrolliert. Ist der Glucosespiegel im Blut niedrig, bewirkt das Hormon Glucagon die Phosphorylierung der Pyruvatkinase, welche dadurch an Aktivität verliert. So bleibt Phosphoenolpyruvat erhalten und steht für die Gluconeogenese zur Verfügung, durch welche neue Glucose in der Leber aufgebaut wird. Auch intrazelluläres Calcium lässt Pyruvatkinase phosphorylieren.
Pyruvatkinase-Defekte
Nur vom PKLR-Allel der Pyruvatkinase sind Mutationen bekannt und nur bei der R-Form zeigen sich diese als Defekt. Mangel an PKR ist eine autosomal-rezessiv vererbte Stoffwechselstörung. Dadurch wird häufig eine hämolytische Anämie verursacht. Überschuss an PKR-Aktivität mit entsprechend erhöhtem ATP in Blutzellen ist als weiterer Defekt bekannt.[1]
Einzelnachweise
Weblinks
Wikimedia Foundation.