- Anaemie
-
Klassifikation nach ICD-10 D50-D53 Alimentäre Anämien D55-D59 Hämolytische Anämien D60-D64 Aplastische und sonstige Anämien ICD-10 online (WHO-Version 2006) Bei einer Anämie ist die Sauerstoff-Transportkapazität des Blutes vermindert. Infolgedessen kann es in ausgeprägten Fällen zu einer Minderversorgung des Körpers mit Sauerstoff (Hypoxie) kommen.
Die Anämie ist in der Medizin definiert als:
- eine Verminderung der Konzentration des roten Blutfarbstoffs (Hämoglobin) und/oder
- eine Verminderung des Hämatokrits (prozentualer Anteil der zellulären Elemente am Blutvolumen) und/oder
- eine Verminderung der Anzahl der roten Blutkörperchen (Erythrozyten) unter die der Altersnorm entsprechenden Menge.
Es handelt sich um ein erworbenes, angeborenes oder durch Erkrankung beziehungsweise Verletzung bedingtes Missverhältnis zwischen der für die Deckung des Sauerstoffbedarfs der peripheren Gewebe notwendigen Konzentration an Hämoglobin und der Bedarfsdeckung. Diesem Defizit und damit den oben beschriebenen Ursachen liegt entweder eine Störung der Bildung roter Blutkörperchen, der Blutbildung im Knochenmark oder ein vermehrter Abbau zugrunde.
Auch Erkrankungen, Verletzungen oder physiologische Zustände (etwa Schwangerschaft oder Menstruation) können durch den damit verbundenen Blutverlust zur Anämie führen, wenn bei der Kompensation oder Behandlung lediglich die Blutplasmamenge ersetzt wird und dadurch die Gesamt-Hämoglobin-Konzentration im Blut abnimmt.
Der Begriff Anämie stammt aus dem Altgriechischen ἄναιμος (anaimos) „blutlos“ und setzt sich zusammen aus der Vorsilbe αν (an) „un-, ohne, nicht“ und dem Wort αἷμα (haima) „Blut“. Im Deutschen werden die Begriffe Blutarmut und Blutmangel synonym verwendet.
Inhaltsverzeichnis
Symptome
Die bei einer Anämie auftretenden Symptome sind entweder eine direkte Folge der Hypoxie oder der Kompensationsmechanismen des Körpers. Patienten merken, infolge der mangelhaften Sauerstoffversorgung des ganzen Körpers, als erste Symptome häufig Leistungsabfall und schnelle Ermüdbarkeit.
Haut und Schleimhäute sind durch Blässe gekennzeichnet, wobei zumindest die Hautblässe abhängig von der Hautfarbe nicht immer leicht erkennbar ist. Durch Unterversorgung des Gehirns mit Sauerstoff können Kopfschmerzen, Ohrgeräusche (Tinnitus), Übelkeit, Ohnmacht (Synkopen), Schlaflosigkeit, Konzentrationsprobleme und Sehstörungen auftreten. Eine Sauerstoffunterversorgung des Herzmuskels (Myokard) führt zu Angina pectoris. Infolge der Hypoxie in den Nieren kann es zu einem geringfügigen Ausscheiden von Blut im Urin (mikroskopischer Hämaturie), einer leichten Eiweißausscheidung (Proteinurie) und einem Rückhalt von Salz und Wasser kommen. Weiterhin können bei länger anhaltender Anämie brüchige Finger- und Fußnägel, Haarausfall und Spliss beobachtet werden.
Da der Körper versucht, den Sauerstoffbedarf der Gewebe trotz der verminderten Sauerstofftransportkapazität des Blutes zu decken, können eine beschleunigte Atmung (Tachypnoe) und ein erhöhter Herzschlag (Tachykardie) auftreten.
Aufgrund der erhöhten Frequenz des Blutumlaufs und damit auch der erhöhten Strömungsgeschwindigkeit des Blutes kann es zu charakteristischen Geräuschen in den Jugularvenen am Hals kommen, dem so genannten Nonnensausen, sowie zu anämischen Strömungsgeräuschen an den Herzklappen, die mit dem Stethoskop wahrnehmbar sind, ohne dass ein struktureller Herzklappenfehler besteht.
Neben diesen allgemeinen Symptomen kann es je nach Anämieform noch zu weiteren Krankheitsbildern kommen. Eine Anämie ist jedoch immer Symptom einer Grunderkrankung oder Fehlernährung, sie kann nie eine vollständige Diagnose sein.
Diagnostik
Normalwerte beim Menschen[1] Bezeichnung Frauen Männer Erythrozyten 4,3 bis 5,2 Mio./μl 4,8 bis 5,9 Mio./μl MCH 28–34 pg MCHC 30–36 g/dl MCV 78–94 fl Retikulozyten 1 % Hämatokrit 37–47 % 40–54 % Ferritin[2] 22–112 µg/l 34–310 µg/l Transferrin[3] 212–360 mg/dl Vitamin B12[4] >300 ng/l Folsäure[5] >2,5 ng/ml Eine Verdachtsdiagnose kann sich bereits aus der Krankengeschichte (Anamnese) und dem allgemeinem körperlichen Befund ergeben. Im Rahmen einer weiteren Ursachenabklärung stehen insbesondere die Suche nach Blutungsquellen (besonders aus Magen, Darm und nach genitalen Blutungen bei Frauen) sowie Hämolysezeichen und ein abgestuftes System von Laboruntersuchungen zur Verfügung.
Dabei ist es wichtig zu unterscheiden, ob es sich bei einer Anämie um eine durch vermehrten Blutverlust/-abbau, oder eine durch Blutbildungsstörung bedingte Blutarmut handelt. Es können auch Mischformen vorkommen. Das wichtigste technische Hilfsmittel für die Diagnose einer Anämie ist das Blutbild.
Die erste Information, die ein Blutbild liefert, ist die, ob überhaupt eine Anämie vorliegt. Es kann dabei, durch Bestimmung von Hämatokrit und Erythrozytenzahl, eine Verminderung der Zellen im Blut anzeigen. Die Werte zu mittlerem Volumen (Mittleres Erythrozyteneinzelvolumen, MCV von engl. mean corpuscular volume) der Erythrozyten und die Erythrozytenverteilungsbreite geben Aufschluss über die Größe der Zellen (und damit Hinweis auf die Ursache, siehe Abschnitt Einteilung). Hämoglobinkonzentration im Blut, Hämoglobingehalt (Mittleres Korpuskuläres Hämoglobin, MCH) und -konzentration (Mittlere Korpuskuläre Hämoglobinkonzentration, MCHC) der Erythrozyten bieten mögliche Hinweise auf Störungen in der Bildung des roten Blutfarbstoffs.
Häufig ist die Anämie Zeichen einer systemischen Erkrankung (zum Beispiel Infektionen oder Tumoren) oder das Leitsymptom einer Störung der Erythropoese (Bildung roter Blutkörperchen).
Beispiele aus der Diagnostik:
- Anhand der Anzahl der Retikulozyten (unreife rote Blutkörperchen) lässt sich feststellen, ob eine Blutbildungsstörung vorliegt, da diese unter normalen Umständen bei einem Verlust an roten Blutkörperchen in erhöhter Anzahl vom Knochenmark freigesetzt werden.
- Die Konzentration der am Eisenstoffwechsel beteiligten Proteine wie Ferritin, Transferrin und Transferrinrezeptor geben Aufschluss über das Vorhandensein einer Eisenmangelanämie, Vitamin B12 und Folsäure einer megaloblastären oder perniziösen Anämie.
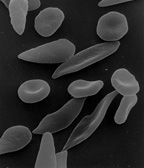
- Auch Formabweichungen der roten Blutkörperchen können Aufschluss über bestimmte Anämien geben (zum Beispiel Sichelzellenanämie).
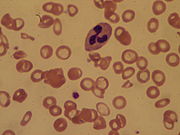
- Ein Knochenmarksausstrich kann zeigen, ob die Ursache im blutbildenden Gewebe im Knochenmark selbst liegt.
Hämoglobin-Gehalt
Die auch heute weitgehend als gewichtig anerkannten Kriterien für die Diagnose von Anämien beruhen auf einem Bericht einer WHO-Expertengruppe aus dem Jahr 1968.[6] Demnach liegt eine Anämie vor, wenn der Hämoglobin-Gehalt folgende Werte unterschreitet:
Personenkategorie Hb-Untergrenze
(g/100 ml)Kinder von 6 Monaten bis 6 Jahren 11 Kinder von 6 bis 14 Jahren 12 Erwachsene Männer 13 Erwachsene Frauen, nicht schwanger 12 Erwachsene Frauen, schwanger 11 Diese Werte wurden aufgrund von neueren Erkenntnissen und größeren Samples angepasst. Neuere Studien in den USA beobachten Unterschiede zwischen physiologischen Hämoglobin-Werten weißer und schwarzer Bevölkerung.[7]
Quelle[7] Männer
Hb-Untergrenze
(g/dl)Frauen
Hb-Untergrenze
(g/dl)WHO 1968 13 12 Jandl 1996 14,2 12,2 Williams (Beutler et al.) 2001 14,0 12,3 Wintrobe (Lee et al.) 1998 13,2 11,6 Rapaport 1987 14 12 Goyette 1997 13,2 11,7 Tietz 1995 13,2 11,7 Hoffman et al. 2004 13,5 12,0 Einteilung
Anämien lassen sich wie folgt einteilen:[8]
- nach der Morphologie in mikro-, makro- oder normozytäre Anämien (MCV)
- nach dem Hämoglobin-Gehalt in normo-, hypo- oder hyperchrome Anämien (MCH)
- nach der Erythropoese in hypo-, normo- oder hyperregenerative Anämien
- in akute oder chronische Anämien
- in angeborene oder erworbene Anämien
Aregenerative Anämie
Abhängig vom Erscheinungsbild der verbleibenden Erythrozyten werden Anämien in der Klinik in drei Gruppen eingeteilt. Betrachtet werden dabei die Größe der Zellen und der Hämoglobingehalt. Bei normal erscheinenden Zellen spricht man von normochromer, normozytärer Anämie, sind diese vermindert, von hypochromer, mikrozytärer Anämie, sind sie erhöht, von hyperchromer, makrozytärer Anämie.
Normochrome, normozytäre Anämie
Während die Zahl der roten Blutkörperchen und damit die Sauerstofftransportkapazität des Blutes reduziert ist, erscheinen die Zellen morphologisch normal. Bei hypoproliferativen Anämien werden infolge eines Mangels oder nicht ausreichender Reaktion auf das Hormon Erythropoetin und Zytokine mit vergleichbarer Wirkung (besonders Interleukin-6 und Interleukin-8) nicht ausreichend neue Erythrozyten produziert, um den Bedarf zu decken. Ursache sind entweder Nierenerkrankungen, da dort Erythropoetin synthetisiert wird (renale Anämie), oder Erkrankungen, die einen hypometabolischen Zustand (niedrigen Stoffwechselzustand) des Patienten verursachen. Dies betrifft insbesondere Schilddrüsenunterfunktion, Hypophyseninsuffizienz oder Eiweißmangel.
Sind die Vorläuferzellen der roten Blutkörperchen verringert, so können ebenso nicht ausreichend neue Zellen in den Kreislauf abgegeben werden. Bei diesen Erkrankungen ist die Konzentration von Erythropoetin im Blut zumeist normal. Aplastische Anämien resultieren aus einem Verlust der Stammzellen. Die Ursache dafür ist häufig unbekannt. Aplastische Anämien sind sehr selten, in Europa treten jährlich 0,2 Fälle/100.000 Einwohner auf, gehäuft während Adoleszenz, Schwangerschaft und im Alter.[9] Manchmal finden sich Chromosomenveränderungen als Ursache (Fanconi-Anämie). Ebenso beschädigen Strahlung, Chemikalien, Infektionen, manche Medikamente und Hypersplenismus das Knochenmark und haben so indirekt eine Anämie zur Folge. Diese Beschädigungen sind jedoch unspezifisch und betreffen auch die Vorläuferzellen der anderen Blutbestandteile. Sind ausschließlich die Vorläufer der Erythrozyten betroffen, spricht man von Erythroblastopenie oder PRCA (von engl. Pure Red Cell Aplasia). Ursache für eine chronische PRCA sind Virusinfekte, chronische PRCA können angeboren oder erworben (durch Erkrankungen der Hämolyse, Thymome, Immunreaktionen oder bei chronischer lymphatischer Leukämie) sein. Schließlich geht beim myelodysplastischen Syndrom die Blutbildung nicht von gesunden, sondern von genetisch veränderten Ursprungszellen aus. Auch dies führt zu Anämie.
Bei der Osteomyelofibrose wird das blutbildende Gewebe im Knochenmark nach und nach durch Bindegewebe ersetzt, so dass keine normale Erythropoese stattfinden kann. Andere Ursachen für eine Degeneration des Knochenmarks sind bestimmte Malignome, Infiltration durch Metastasen, maligne Lymphome oder Leukämien.
Hyperchrome, makrozytäre Anämie
Diese werden auch als megaloblastäre Anämien bezeichnet. Infolge von Vitamin B12- oder Folsäuremangel ist die Produktion roter Blutkörperchen eingeschränkt. Am häufigsten treten diese, mit einer Inzidenz von 9 Fällen/100.000 Einwohner/Jahr, infolge von Vitamin-B12-Mangel auf.[9]
Vitamin B12 (Cobalamin) wird im Körper bei der DNA-Synthese benötigt. Da nicht genügend DNA für die Zellteilung verfügbar ist, kommt es zu vergrößerten Zellen. Der Mangel an Vitamin B12 kann verschiedene Ursachen haben:
- Nicht ausreichende Aufnahme mit den Nahrungsmitteln
- Malabsorption:
-
- Für die Aufnahme von Vitamin B12 in die Darmschleimhaut muss dieses mit dem sog. Intrinsic-Faktor (IF) gebunden sein. Ist dieser nicht oder nicht ausreichend vorhanden, kann Vitamin B12 nicht absorbiert werden. Die Ursache hierfür kann entweder genetisch oder erworben sein. Erworbene Ursachen sind entweder Gastrektomien (operative Entfernung des Magens), oder Autoimmunerkrankungen (dieses Krankheitsbild wird als perniziöse Anämie bezeichnet). Eine weitere mögliche Ursache für Malabsorption ist die Hemmung der Bindung von IF an Cobalamin oder die Bindung des Komplexes aus den beiden an Rezeptoren im Ileum (Krummdarm). Ursache hierfür sind ebenso Autoimmunerkrankungen.
- Erkrankungen des Ileums können ebenso die Aufnahme von Cobalamin hemmen. Hierzu gehören die Zöliakie, Enteritis, Intestinale Tuberkulose und Resektionen des Ileums.
- Bandwurmbefall kann auch Vitamin-B12-Mangel auslösen, da die Bandwürmer größere Mengen Vitamin B12 entziehen.
- Mangel von Transcobalamin II, dem Transportprotein für Vitamin B12 im Blut
- Während Schwangerschaft, in der Kindheit, bei bösartigen Tumorerkrankungen und bei erhöhter Hämatopoese ist der Bedarf an Vitamin B12 erhöht. Wird dieser gesteigerte Bedarf nicht mit entsprechend vermehrter Aufnahme durch die Nahrung gedeckt, kann es ebenso zu Mangelerscheinungen kommen.
Folsäure (genauer Tetrahydrofolsäure) wirkt als Coenzym bei der Synthese von Purinen, Thymin und Methionin. Bei einem Mangel kommt es auch zur Störung der DNA-Synthese. Mögliche Ursachen:
- Nicht ausreichende Aufnahme
- Malabsorption infolge von Zöliakie, Medikamenten (Barbiturate, Phenytoin), Alkohol
- Störungen des Metabolismus infolge von Dihydrofolatreduktasemangel oder -hemmung
- Zytotoxische Medikamente, die die DNA-Synthese hemmen
- Erhöhter Bedarf während der Schwangerschaft, Kindheit, bei bösartigen Tumorerkrankungen und erhöhter Hämatopoese.
Hypochrome, mikrozytäre Anämie
Hypochrome, mikrozytäre Anämien treten zumeist infolge von Eisenmangel oder Problemen mit der Nutzung des Eisens im Körper auf.
Eisenmangelanämie ist mit einem Anteil von 80 % bei weitem die häufigste Form der Anämie. In Europa leiden etwa 10 %, in den Entwicklungsländern mehr als 50 % der Frauen im gebährfähigen Alter darunter. Allgemein sind 80 % der Patienten weiblich.[9] Ursache ist zumeist erhöhter Verlust an Eisen durch unerkannte Blutungen, zum Beispiel im Verdauungstrakt, oder durch erhöhte intravaskuläre Hämolyse (s. a. Abschnitt zur hämolytischen Anämie). Weitere mögliche Ursachen sind mangelhafte Absorption infolge von Durchfall, Magensäuremangel oder Gastrektomie, nicht ausreichende Aufnahme mit der Nahrung oder erhöhter Bedarf im Entwicklungsalter, bei Schwangerschaft oder während der Menstruation. Im Knochenmark ist die Anzahl unreifer Normoblasten (Vorläuferzellen der Erythrozyten) erhöht.
Wenn das Eisen nicht von seinen Speicherorten zu den Orten der Blutbildung im Knochenmark gelangen kann, kann dies ebenso eine Anämie zur Folge haben. Ursachen sind entweder genetische Defizite oder Defekte des Eisentransportproteins Transferrin oder Verlust in den Nieren beim nephrotischen Syndrom. Mangelhafte Eisennutzung tritt zudem entweder bei Hämoglobinopathien, wie z. B. Thalassämie oder Sichelzellenanämie oder Aufbaustörungen der Häm-Gruppe wie Porphyrien auf.
Bei einer erworbenen, angeborenen oder idiopathischen Verwertungsstörung von Eisen kommt es zur Einlagerung von Eisen in Erythroblasten (s.g. Sideroblasten, sideroblastische oder sideroachrestische Anämie), dem Monozyten-Makrophagen-System und in parenchymatösen Organen wie der Leber bei gleichzeitig meist erhöhtem Serumeisen. Parallel sind Blutplättchen und weiße Blutkörperchen häufig ebenfalls vermindert.[10]
Chronische Erkrankungen wie Krebs, Autoimmunerkrankungen (Systemischer Lupus erythematodes oder Rheumatoide Arthritis), akute und chronische Infektionen können ebenso Anämien verursachen. Die Freisetzung von Zytokinen durch aktivierte T-Lymphozyten und Makrophagen (Fresszellen) regt die vermehrte Einlagerung von Eisen in Zellen des retikuloendothelialen Systems an, das dann anderswo nicht mehr zur Verfügung steht. Außerdem hemmen Zytokine direkt die Erythropoese. Im Falle von bösartigen Tumorerkrankungen spricht man dann von Tumoranämie.
Regenerative Anämie
Regenerative Anämien können unterschieden werden in solche, die nach akuten oder chronischen Blutungen auftreten (Blutungsanämien) und mit einem hohen Blutverlust einhergehen, und solche, die aus einer abnormal hohen Zerstörung der Erythrozyten resultieren (hämolytische Anämie).
Blutungsanämie
Die Wiederherstellung der normalen Anzahl roter Blutkörperchen bei Anämien nach plötzlichen, starken (akuten) Blutungen kann in drei Phasen unterteilt werden. Direkt nach der Blutung ist die Zahl roter Blutkörperchen normal, da durch die Ausschüttung von Katecholaminen (Adrenalin und Noradrenalin) rote Blutkörperchen aus Reservoirs (hauptsächlich aus der Milz) mobilisiert werden (hämodynamische Kompensation). In der zweiten Phase, der plasmatischen Kompensation, wenige Stunden später, wird, um den Blutdruck aufrecht zu erhalten, das Renin-Angiotensin-Aldosteron-System aktiviert und Vasopressin ausgeschüttet. Durch die folgende Zurückhaltung von Wasser und den Einstrom von Gewebsflüssigkeit kommt es zur Verdünnung des Blutes und damit zur Reduzierung von Hämatokrit und relativer Anzahl roter Blutkörperchen, und letztendlich zur normochromen, normozytären Anämie. Die zelluläre Kompensation beginnt mit der Ausschüttung von Erythropoeitin infolge der Gewebshypoxie. Dies regt die Bildung neuer Erythrozyten an und verursacht außerdem eine erhöhte Anzahl von Retikulozyten im Blut, da diese vermehrt und vorzeitig aus dem Knochenmark freigelassen werden. Bis zu einem vollständig normalen Blutbild können sechs bis acht Wochen vergehen, abhängig von der Menge des verlorenen Blutes und der Menge des im Körper gespeicherten Eisens.
Chronische Blutungen (im Verdauungstrakt, gynäkologische Blutungen, hämorrhagische Diathese) führen zumeist zu Eisenmangelanämien.
Hämolytische Anämie
Anämien infolge erhöhter Zerstörung der Erythrozyten werden als hämolytische Anämien bezeichnet. Man unterscheidet zwischen korpuskulären hämolytischen Anämien, bei denen die Ursache in den Erythrozyten liegt, und extrakorpuskulären hämolytischen Anämien, bei denen die Erythrozyten von außen zerstört werden. Durch die Zerstörung der Erythrozyten werden die im Inneren der Zellen befindlichen Stoffe freigesetzt. Deshalb steigt der Plasmaspiegel von Kalium, Lactatdehydrogenase, freiem (ungebundenem) Hämoglobin, unkonjugiertem Bilirubin und Eisen. Auch die Sättigung von Transferrin mit Eisen nimmt zu, was zu einer Reduzierung der Eisenbindefähigkeit des Körpers führt. Außerdem nimmt der Plasmaspiegel von Haptoglobin und Hämopexin ab. Der erhöhte Bilirubingehalt führt zu pleiochromem (dunklem) Stuhl und eventuell Ikterus (Gelbsucht). Der Urobilinogengehalt des Urins ist erhöht, Hämoglobinurie und eventuell Proteinurie können beobachtet werden.
Korpuskulären hämolytischen Anämien liegt meist ein genetischer Defekt eines der Bestandteile der Erythrozyten zugrunde. Handelt es sich um einen Defekt der Zellmembran, so treten, je nachdem welches Protein durch die Mutation betroffen ist, Kugelzellenanämie (Sphärozytose, bei einem Defekt im Zytoskelett, genauer Spektrin oder Ankyrin), Elliptozytose (defektes Spektrin oder Protein 4.1), Stomatozytose (genauer Defekt unbekannt) oder Akanthozytose (Abwesenheit von Apolipoprotein B) auf. Die Paroxysmale nächtliche Hämoglobinurie (PNH) resultiert ebenso aus einem Defekt der Zellmembran, aufgrund einer erworbenen Mutation des pig-A Gens ist die Bindung mehrerer Proteine mit der äußeren Zellmembran mangelhaft. Infolgedessen wird durch den pH-Abfall des Blutes in der Nacht (daher der Name) die Hämolyse begünstigt. PNH tritt mit einer Inzidenz von weniger als 1/100.000/Jahr auf.[9] Eine weitere Ursache kann der Mangel eines der Enzyme innerhalb der Erythrozyten sein (Glucose-6-Phosphatdehydrogenase-Mangel (Favismus) oder Pyruvatkinasemangel). Letztendlich können Defekte in der Synthese von Hämoglobin, die so genannten Hämoglobinopathien, zur Lysis von Erythrozyten und daraus resultierender Anämie führen. Besonders hervorgehoben seien hier die Thalassämien und die Sichelzellanämie.
Extrakorpuskuläre hämolytische Anämien werden durch Ursachen außerhalb der Erythrozyten verursacht. Zum einen betrifft dies die mechanische Zerstörung der Zellen, zum Beispiel an künstlichen Herzklappen oder infolge mikroangiopathischer Prozesse, insbesondere Disseminierte intravasale Koagulopathie, Thrombotisch-thrombozytopenische Purpura und Hämolytisch-urämisches Syndrom. Plasmodien, die Erreger der Malaria, vermehren sich in roten Blutkörperchen und zerstören diese letztendlich. Weiterhin können Chemikalien wie Kupfer und Blei, aber auch destilliertes Wasser und Toxine wie Schlangen- und Spinnengifte oder Bienenstiche zur Hämolyse führen. Zudem können hämolytische Anämien in seltenen Fällen als Komplikationen von Clostridiuminfektionen auftreten. Bei Immunhämolysen werden die Erythrozyten durch eigene oder fremde (Graft-versus-Host-Reaktion) Abwehrreaktionen zerstört. Dies kommt entweder als Reaktion auf ein fremdes Antigen bei Transfusionsreaktionen oder inkompatible Rhesus-Faktoren zwischen Mutter und Fetus (Morbus haemolyticus neonatorum) oder als Autoimmunerkrankung gegen eigene auf den Zellen gelegene Antigene vor. Diese autoimmunhämolytischen Anämien werden in einen warmen und einen kalten Typ unterschieden. Beim warmen Typ (70 % aller Patienten[9]) binden IgG-Antikörper an die Oberfläche der roten Blutkörperchen und sorgen somit dafür, dass diese in der Milz aus der Zirkulation entfernt werden. Ursachen sind entweder idiopathisch oder Autoimmunerkrankungen wie systemischer Lupus erythematodes, rheumatoide Arthritis oder auch chronische lymphatische Leukämie. Beim kalten Typ binden im peripheren Kreislauf infolge von Kälteeinwirkung IgM-Antikörper an die Erythrozyten und verursachen dadurch Agglutination (Verklumpung) der Zellen, was zu schmerzhafter Akrozyanose (Blaufärbung der Körperanhänge) führt. Dies kann ebenso idiopathisch oder als Folge von Infektionen mit Mycoplasma pneumoniae, Pfeiffer-Drüsenfieber und lymphoproliferativen Krankheiten auftreten. Nach Virusinfekten im Kindesalter kann es ebenso, vermittelt durch IgG-Antikörper, akut zur so genannten bithermischen Hämolyse kommen. Diese geht aber in der Regel nach Abklingen des Infekts ohne Komplikationen zurück.
Behandlung
Die Behandlung von Anämien zielt zuvorderst darauf ab, die Ursachen zu beseitigen.
Bei Patienten, die nicht menstruieren, sind Eisenmangelanämien in Folge mangelhafter Eisenaufnahme durch die Nahrung selten. Deswegen müssen bei diesen Patienten Blutungen im Verdauungstrakt als mögliche Ursache der Anämie ausgeschlossen werden. Das benötigte Eisen wird zumeist oral, in seltenen Fällen (entzündliche Magen-/Darmerkrankungen, Malabsorption, schlechte Verträglichkeit der oralen Gabe) auch parenteral als Injektion verabreicht.
Megaloblastäre Anämien werden durch Beseitigung der Ursachen (etwa Behandlung der Bandwurmerkrankung) und parenterale Gabe von Vitamin-B12 oder Vitamin B6 behandelt.
Liegt die Ursache in einer nicht ausreichenden Blutbildung durch genetisch bedingte Defekte, kann eine Knochenmarksspende Heilung oder Linderung versprechen.
Allgemein gilt, dass eine langsam (etwa über Monate) entstandene Anämie vom Patienten besser toleriert wird als eine, die durch eine massive Blutung innerhalb von Stunden entsteht, da der Körper sich an den lang anhaltenden Hämoglobinmangel anpasst. Akute Blutungen werden durch Transfusion von Erythrozyten-Konzentraten behandelt. Genaue Richtwerte, ab denen eine Transfusion notwendig ist, existieren nicht. Statt dessen müssen neben Blutwerten Dauer, Schwere und Ursache der Anämie sowie Vorgeschichte, Alter und klinischer Zustand des Patienten in Betracht gezogen werden. Der Blutspendedienst des DRK gibt als Richtwert ein Abfallen des Hämatokrit in Folge von akutem Blutverlust unter 30 % bei schwerkranken Patienten mit Herz-Kreislauf-Erkrankungen und 20 % bei organgesunden, belastbaren Patienten an.[11] Bei weniger stark ausgeprägtem Abfall genügt die Volumensubstitution mit Infusionen.[12]
Weiterhin stehen zur Anregung der Blutbildung Antianämika, die eine ähnliche Wirkung wie Erythropoeitin aufweisen, zur Verfügung.
Einzelnachweise
- ↑ Laborlexikon, e-Journal für Labormedizin, ISSN 1860-966X zum kleinen Blutbild
- ↑ Laborlexikon zu Ferritin
- ↑ Laborlexikon zu Transferrin
- ↑ Laborlexikon zu Vitamin B12
- ↑ Laborlexikon zu Folsäure
- ↑ Nutritional anaemias. Report of a WHO scientific group. World Health Organ Tech Rep Ser. 1968; 405:5-37. [1]
- ↑ a b Ernest Beutler, Jill Waalen: The definition of anemia: what is the lower limit of normal of the blood hemoglobin concentration? Blood. 2006; 107:1747-1750. [2]
- ↑ G. Halwachs-Baumann (Hrsg.): Labormedizin. Klinik - Praxis - Fallbeispiele. Springer, WienNewYork 2006.
- ↑ a b c d e Herold G. et al.: Innere Medizin, 2007
- ↑ Roche Lexikon Medizin [Elektronische Ressource] 5. Auflage; Elsevier GmbH, Urban & Fischer Verlag; München/Jena 2003; ISBN 3-437-15072-3; Online-Version Stichworte: Anämie, sideroachrestische und Sideroblast
- ↑ P. Kühnl et al.: Transfusion von Blutkomponenten und Plasmaderivaten [3]
- ↑ Leitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten, 3. überarbeitete und erweiterte Auflage, herausgegeben von der Bundesärztekammer, aufgerufen am 13. November 2007
Literatur
- Tinsley R. Harrison u.a.: Harrison’s Principles of Internal Medicine. Mcgraw-Hill Professional, 2005, ISBN 978-0-07-007272-5.
- M. Wick u.a.: Eisenstoffwechsel, Anämien. Diagnostik und Therapie. Neue Konzepte bei Renaler Anämie und Rheumatoider Arthritis. Springer Verlag., Wien, 2002, ISBN 978-3-211-83802-0.
- G. Beutel, u.a.: Anämie auf einen Blick. Thieme Verlag, Stuttgart, 2003, ISBN 978-3-13-137881-1.
- Bruno de Benoist, Erin McLean, Ines Egli, Mary Cogswell (all Edit.): Worldwide prevalence of anaemia 1993–2005 : WHO global database on anaemia (PDF, 51S, 687kb), World Health Organization, 2008, ISBN 978-92-4-159665-7.
Weblinks
- Anämiediagramm der Uni-Heidelberg
- Sichelzellstudie Deutschland an der Uni Bonn
- Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie: Anämiediagnostik im Kindesalter
- Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie: Aplastische Anämie
- Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie: Sichelzellerkrankung
- Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie: Thalassämie
- OrphaNet: Sideroblastic anemia
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.