- RGT
-
Die RGT-Regel (Reaktionsgeschwindigkeit-Temperatur-Regel, auch Van ’t Hoffsche Regel) ist eine Faustregel die besagt, dass sich die Reaktionsgeschwindigkeiten von chemischen Reaktionen bei einer Temperaturerhöhung von 10 °C verdoppeln bis vervierfachen. Eine Temperaturerhöhung um 50 °C würde somit zu einer 32−fachen bis 1024−fachen Reaktionsgeschwindigkeit führen. Bei einem Anstieg um 100 °C sind 210− bis 410−fache Geschwindigkeiten zu erwarten.
Die Regel wurde 1884 von dem niederländischen Chemiker van ’t Hoff aufgestellt und von Arrhenius 1898 genauer beschrieben. Sie erlaubt die überschlägige Abschätzung vieler Phänomene der Chemie, Biochemie und Ökologie.
Grundlagen der Regel
Die Regel gilt für chemische Reaktionen, für die eine relativ hohe Aktivierungsenergie erforderlich ist. Die Aktivierungsenergie ist eine der Ursachen für die Langsamkeit einer Reaktion, obwohl aus thermodynamischer Sicht die Reaktion günstig ist, also eine exergone Reaktion vorliegt. In der Regel sind diese Reaktionen keine Gleichgewichtsreaktionen und laufen nur in eine Richtung ohne Rückreaktionen ab. Bestimmend ist die Kinetik der Reaktion. Typische Beispiele sind Reaktionen 2. Ordnung:
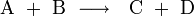 , oder
, oder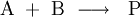
Dabei sind A und B die Edukte, C, D bzw. P die Produkte der chemischen Reaktion. Die Reaktionsgeschwindigkeit v hängt von den Konzentrationen der Edukte [A] und [B] ab, während die Konzentrationen der Produkte keine Rolle spielen. k ist die Geschwindigkeitskonstante der jeweiligen Reaktion und hängt von verschiedenen Details des Reaktionsablaufs ab:
Grundvoraussetzung einer Reaktion ist das Zusammenstoßen der Edukte. Bei langsamen Reaktionen sind jedoch fast alle Zusammenstösse folgenlos. Nur Reaktionspartner, die heftig genug aufeinander prallen, können reagieren, da sie eine Aktivierungsenergie EA (den Übergangszustand) überwinden müssen. Die mittlere kinetische Energie der Reaktionspartner steigt mit der Temperatur, der Anteil der Reaktionspartner mit genügend Energie auch. Zusammenstösse werden häufiger und führen häufiger zur Reaktion. Die Arrhenius-Gleichung zerlegt die Geschwindigkeitskonstante k in
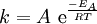 mit A: präexponentieller Faktor, R: allgemeine Gaskonstante und T: die absolute Temperatur
mit A: präexponentieller Faktor, R: allgemeine Gaskonstante und T: die absolute Temperatur
Der Faktor
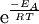 beschreibt den Anteil der Reaktionspartner, die zur Überwindung des Übergangszustands über genügend kinetische Energie verfügen. Der Faktor hängt von der Temperatur ab und kann zwischen Null (keiner verfügt über genügend Energie) und eins (alle verfügen über genügend Energie) liegen. Der Faktor A ist eine reaktionsspezifische Größe und wird unter der Stoßtheorie näher beschrieben. Die Arrhenius-Gleichung und damit die RGT-Regel gelten für Fälle, bei denen nur ein kleiner Bruchteil der Reaktionspartner über genügend kinetische Energie verfügt und somit eine höhere Temperatur zu einem deutlichen Anstieg dieses Anteils führt.
beschreibt den Anteil der Reaktionspartner, die zur Überwindung des Übergangszustands über genügend kinetische Energie verfügen. Der Faktor hängt von der Temperatur ab und kann zwischen Null (keiner verfügt über genügend Energie) und eins (alle verfügen über genügend Energie) liegen. Der Faktor A ist eine reaktionsspezifische Größe und wird unter der Stoßtheorie näher beschrieben. Die Arrhenius-Gleichung und damit die RGT-Regel gelten für Fälle, bei denen nur ein kleiner Bruchteil der Reaktionspartner über genügend kinetische Energie verfügt und somit eine höhere Temperatur zu einem deutlichen Anstieg dieses Anteils führt.Komplexere Reaktionen
Die Regel kann auch für komplexe Reaktionen gelten, wenn ein Teilschritt der Reaktion klar die Gesamtgeschwindigkeit der Reaktion bestimmt. Dazu können auch katalytische Reaktionen (auch Enzymkinetik) zählen.
Hier ist die Bildung von AB eine schnelle Gleichgewichtsreaktion, kinetisch bestimmend ist jedoch die Bildung von P und B aus AB. Ein solche Teilreaktion kann z.B. eine katalytische Reaktion mit dem Katalysator B sein. Die RGT-Regel bietet auch Erklärung für die Wirkung von Schnellkochtöpfen auf die Garzeit von Speisen oder der temperaturabhängigen Aktivität von wechselwarmen Tieren. Allgemein haben komplexe Systeme jedoch eine sehr begrenzte Temperaturtoleranz, da auch unerwünschte bzw. schädliche Nebenreaktionen bei höheren Temperaturen gefördert werden.
Wikimedia Foundation.

![v=k\cdot\mathrm{[A]}\cdot\mathrm{[B]}](/pictures/dewiki/97/a4404cfced0c39b7b0b347a8070fb21c.png)
![\mathrm{ A \ + \ B \ \rightleftharpoons \ AB \ \xrightarrow[k]{ } \ P \ + \ B}](/pictures/dewiki/98/b12715cbbd6a25bb011acbde17de78d5.png)