- Salsolinol
-
Strukturformel 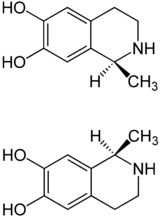
(S)-Salsolinol (oben) und (R)-Salsolinol (unten) Allgemeines Freiname Salsolinol Andere Namen 1-Methyl-6,7-dihydroxy-1,2,3,4-
tetrahydroisochinolin (IUPAC)Summenformel - C10H13NO2 [Salsolinol]
- C10H13NO2·HBr [Salsolinol·Hydrobromid]
CAS-Nummer - 525-72-4 [(RS)-Salsolinol]
- 27740-96-1 [(S)-Salsolinol]
- 53622-83-6 [(R)-Salsolinol]
- 59709-57-8 ([(RS)-Salsolinol·Hydrobromid])
- 70681-20-8 ([(RS)-Salsolinol·Hydrochlorid])
PubChem 54456 Kurzbeschreibung grauer Feststoff[1]
Eigenschaften Molare Masse 179,22 g·mol−1 [Salsolinol] Schmelzpunkt Löslichkeit sehr gering in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] Hydrobromid
keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 36/37/38 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Salsolinol ist ein Isochinolin-Alkaloid, das als Racemat mit bis zu 25 µg/g in Schokolade und Kakao vorkommt[3], aber auch im Organismus endogen gebildet werden kann. Da Salsolinol neurotoxische Eigenschaften hat, wird es zur Gruppe der endogenen Neurotoxine gezählt. Die Ursachen für die Neurotoxizität von Salsolinol sind bisher nicht abschließend geklärt. Gesichert ist, dass Salsolinol verschiedene Enzyme und Enzymkomplexe hemmt, wie beispielsweise die Monoamin-Oxidase sowie die Tyrosinhydroxylase, und zu oxidativem Stress führt.[3][4] Die Substanz steht im Verdacht, eine wichtige Rolle bei der Pathogenese der Parkinson-Krankheit zu spielen.[5]
Synthese
Salsolinol wird biochemisch aus Dopamin und Pyruvat synthetisiert. Katalysiert wird die biochemische Synthese durch das Enzym Salsolinol-Synthase. Dabei entsteht (R)-(+)-Salsolinol.
Im Labor wird das Racemat (RS)-Salsolinol aus Dopamin und Acetaldehyd durch eine Pictet-Spengler-Reaktion gebildet. Beim Gebrauch im Labor wird statt der flüssigen Base meist das feste Hydrobromid-Salz eingesetzt.[1]
Stereoisomerie
Salsolinol ist chiral und enthält ein Stereozentrum. Es existieren also zwei Enantiomere, das (S)-Salsolinol und das (R)-Salsolinol. Die Enantiomere besitzen unterschiedliche Cytotoxizität: (S)-Salsolinol ist zytotoxischer (IC50 = 67 μmol·l−1) als (R)-Salsolinol (IC50 = 167 μmol·l−1).[6]
Einzelnachweise
- ↑ a b c Datenblatt Salsolinol bei Acros, abgerufen am 19. Februar 2010.
- ↑ a b c Datenblatt Salsolinol bei Sigma-Aldrich, abgerufen am 19. Februar 2010.
- ↑ a b M. F. Melzig, I. Putscher, P. Henklein, H. Haber: In vitro pharmacological activity of the tetrahydroisoquinoline salsolinol present in products from Theobroma cacao L. like cocoa and chocolate, in: Journal of Ethnopharmacology, 2000, 73, S. 153–159; doi:10.1016/S0378-8741(00)00291-9.
- ↑ J. H. Kang: Salsolinol, a tetrahydroisoquinoline catechol neurotoxin, induces human Cu,Zn-superoxide dismutase modification, in: J. Biochem. Mol. Biol., 2007, 40 (5), S. 684–689; PMID 17927901.
- ↑ Informationen der Human Metabolome Database.
- ↑ M. F. Melzig, I. Putscher, H. Haber, M. Rottmann und J. Zipper: Toxicity and Pharmacological Effects of Salsolinol in Different Cultivated Cells in A. Moser: Pharmacology of Endogenous Neurotoxins, Birkhäuser Verlag Boston (1998), ISBN 978-0-8176-3993-8, S. 253.
Wikimedia Foundation.
