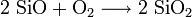- Siliziummonoxid
-
Strukturformel Keine Strukturformel vorhanden Allgemeines Name Siliciummonoxid Andere Namen keine
Summenformel SiO CAS-Nummer 10097-28-6 Kurzbeschreibung dunkelbraun bis anthrazitfarben Eigenschaften Molare Masse 44,09 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt > 1702 °C[1]
Siedepunkt 1880 °C[1]
Löslichkeit unlöslich in Wasser, löslich in Flusssäure
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Siliciummonoxid (auch Siliziummonoxid) ist eine Verbindung aus Silicium und Sauerstoff. Sie existiert in verschiedenen Modifikationen, von denen aber nur eine von praktischer und kommerzieller Bedeutung ist. Bei dieser handelt es sich um einen dunkelbraunen bis anthrazitfarbenen, amorphen Feststoff.
Siliciummonoxid kommt in keiner der bekannten Modifikationen in der Natur vor, sondern wird ausschließlich synthetisch hergestellt.
Inhaltsverzeichnis
Gewinnung und Darstellung
Wird Siliciumdioxid mit elementarem Silicium im Vakuum auf mindestens 1250 °C erhitzt, so entsteht gasförmiges, monomolekulares SiO, das beim Abkühlen wieder in die Ausgangsstoffe disproportioniert. Durch Abschrecken des Gases auf kalten Oberflächen kann jedoch die dunkle, amorphe Form des SiO als Feststoff gewonnen werden.
Eigenschaften
Physikalische Eigenschaften
Die dunkelbraune, amorphe Modifikation von Siliciummonoxid (SiO)x besteht aus polymeren Si-O-Ketten und ist glasartig und spröde.
Das molekulare Siliciummonoxid SiO ist isoster zum Kohlenstoffmonoxid CO. Es kann als Monomer nur in einer Edelgas-Matrix isoliert werden. Die Bildungsenthalpie beträgt −99,6 kJ/mol und der Si-O-Abstand 0,1509 nm.
Ferner gibt es noch eine gelbe, pulverförmige und eine schwarze, faserartige Modifikation.
Chemische Eigenschaften
Siliciummonoxid ist ein starkes Reduktionsmittel. So reagiert es schon bei Raumtemperatur mit Luftsauerstoff schnell zu Siliciumdioxid weiter.
Eine oberflächlich gebildete Siliciumdioxidschicht schützt allerdings das darunter liegende SiO durch Passivierung, sodass das Material viele Jahre unverändert haltbar ist. SiO in sehr feiner Verteilung ist dagegen pyrophor.
Ab etwa 600 °C zerfällt (SiO)x in SiO2 und Silicium. Die Geschwindigkeit des Zerfalls steigt mit zunehmender Temperatur.
Verwendung
Siliciummonoxid wird in großem Maßstab als Material zur Vergütung von optischen Linsen verwendet. Dabei wird SiO in einem PVD-Prozess im Vakuum verdampft (wobei monomolekulares SiO in der Gasphase entsteht) und in einer dünnen Schicht auf den Linsen niedergeschlagen. Je nach dem im Prozess eingestellten Sauerstoff-Partialdruck scheidet sich die Schicht als SiO, Si2O3 oder SiO2 ab. Die Linsen werden so gehärtet oder – in Kombination mit Schichten aus anderen Aufdampfmaterialien – entspiegelt.
Ferner wird Siliciummonoxid auch als Ausgangsstoff für die Synthese anderer Silicium-Verbindungen verwendet, z. B. von Siliciumcarbid oder Siliciumnitrid.
Einzelnachweise
Literatur
- Römpp Chemie-Lexikon, 9. Auflage. Thieme-Verlag.
- Holleman-Wiberg: Lehrbuch der Anorganischen Chemie. Walter de Gruyter, Berlin, New York 1985, ISBN 3-11-007511-3.
Wikimedia Foundation.