- Fluorsulfonsäure
-
Strukturformel 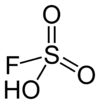
Allgemeines Name Fluorsulfonsäure Andere Namen - Fluorschwefelsäure
- Schwefelsäurefluorid
- Schwefelsäuremonofluorid
Summenformel HSO3F CAS-Nummer 7789-21-1 PubChem 24603 Kurzbeschreibung farblose, stechend riechende Flüssigkeit[1]
Eigenschaften Molare Masse 100,06 g·mol–1 Aggregatzustand flüssig
Dichte 1,74 g·cm–3 (15 °C)[1]
Schmelzpunkt Siedepunkt 162,6 °C[1]
Dampfdruck Löslichkeit Zersetzung in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 

Gefahr
H- und P-Sätze H: 332-314 EUH: keine EUH-Sätze P: 280-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 20-35 S: (1/2)-26-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fluorsulfonsäure ist eine farblose Flüssigkeit und eine der stärksten kommerziell verfügbaren Säuren. Sie ist auch unter dem Namen Fluorschwefelsäure bekannt. Das Molekül ist mit der Formel HOSO2F besser beschrieben, weil es die Verbindung zur Schwefelsäure (H2SO4) genauer ausdrückt. FSO3H ist ein tetraedrisches Molekül.
Inhaltsverzeichnis
Gewinnung und Darstellung
Fluorsulfonsäure wird hergestellt durch die Reaktion von Fluorwasserstoff und Schwefeltrioxid:
Alternativ, kann KHF2 oder CaF2 bei 250 °C mit Dischwefelsäure behandelt werden. Einmal befreit von Flusssäure durch Spülung mit einem Inertgas kann HSO3F in einem Glasgefäß destilliert werden.
Chemische Eigenschaften
Fluorsulfonsäure ist löslich in polaren organischen Lösungsmitteln (z.B. Nitrobenzen, Diethylether, Essigsäure und Ethylacetat), aber schlecht löslich in unpolaren Lösungsmittel wie Alkanen. Durch ihre große Stärke löst sie fast alle organischen Verbindungen auf, die auch nur schwache Protonenakzeptoren sind. FSO3H hydrolysiert langsam zu Flusssäure und Schwefelsäure. Die ihr ähnliche Trifluormethansulfonsäure CF3SO3H ist eine ähnlich starke Säure, aber hydrolytisch stabil.
FSO3H ist eine der stärksten bekannten einfachen Brønsted-Säuren, obgleich aktuelle Arbeiten über Carboran-Säuren zu stärkeren Säuren geführt haben. Sie hat einen H0-Wert von −15, verglichen mit −12 für Schwefelsäure. Die Kombination von FSO3H und der Lewis-Säure Antimon(V)-fluorid ergibt "magische Säure", die eine noch stärkere Säure ist. Diese Säuren werden als "Supersäuren" bezeichnet (Säuren, die stärker sind als 100%ige Schwefelsäure).
Verwendung
Fluorsulfonsäure wird zur chemischen Synthese von Fluorverbindungen, in der Glasindustrie und als Katalysator für chemische Synthesen verwendet. Sie isomerisiert Alkane und katalysiert die Alkylierung von Kohlenwasserstoffen mit Alkenen. Sie kann auch als Fluorierungsmittel und im Gemisch mit Antimonpentafluorid als besonders starkes Protonierungsmittel (Supersäure) verwendet werden.[1]
Sicherheitshinweise
Fluorsulfonsäure ist stark ätzend und greift bei Vorhandensein von Feuchtigkeit oder Wasser Glas und andere siliziumhaltige Materialien sowie die meisten Metalle stark an. Sie hydrolysiert unter Abgabe von Flusssäure. Die Zugabe von Wasser zu HSO3F ist ähnlich gefährlich wie die Zugabe von Wasser zu konzentrierter Schwefelsäure.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 7789-21-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18,8,2007 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 7789-21-1 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Fluorosulfonic acid bei Sigma-Aldrich, abgerufen am 1. April 2011.
Wikimedia Foundation.

