- Bariumnitrat
-
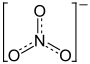
Strukturformel 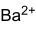
Allgemeines Name Bariumnitrat Andere Namen Barytsalpeter
Summenformel - BaN2O6
- Ba(NO3)2
CAS-Nummer 10022-31-8 PubChem 24798 Kurzbeschreibung weißer Feststoff[1]
Eigenschaften Molare Masse 261,35 g·mol−1 Aggregatzustand fest
Dichte 3,2 g·cm−3 [1]
Schmelzpunkt Löslichkeit mäßig in Wasser (90 g·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 272-302+332 EUH: keine EUH-Sätze P: 210-302+352 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Brand-
förderndGesundheits-
schädlich(O) (Xn) R- und S-Sätze R: 8-20/22 S: (2)-28 MAK 0,5 mg·m−3[1]
LD50 355 mg·kg−1[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumnitrat ist ein Nitratsalz des Erdalkalimetalls Barium. Es besitzt die Formel Ba(NO3)2 und gehört zur Stoffgruppe der Nitrate.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bariumnitrat lässt sich durch folgende chemische Reaktionen darstellen:
Eigenschaften
Bariumnitrat tritt als farbloser kristalliner Feststoff auf. Es ist gesundheitsschädlich und ein schwach wassergefährdender Stoff. Es verursacht in der Brennerflamme die für Barium typische grüne Flammenfärbung und kann als Oxidationsmittel benutzt werden.
Bariumnitrat zersetzt sich bei Temperaturen größer 550 °C zu Bariumoxid, Stickstoff, Sauerstoff und Stickstoffmonoxid. Aufgrund des frei gesetzten Sauerstoffs und vor allem des freiwerdenden Stickstoffmonoxids ist Bariumnitrat ein gutes Oxidationsmittel.
Verwendung
Bariumnitrat wird in der Pyrotechnik zur Herstellung von Feuerwerkskörpern und farbigen Wunderkerzen verwendet, weil es Flammen grün färbt und gleichzeitig ein Oxidationsmittel ist. Außerdem wird es als Oxidator in den Zündhütchen von Patronen und Kartuschen verwendet. Eine hochbrisante Mischung aus TNT und Bariumnitrat wird Baratol genannt.
Es wird auch in Leuchtschirmen für Fernsehempfänger benutzt.
Analytik
Einen ersten Hinweis bei der Identifizierung von Barium in Bariumnitrat erhält man durch die grüne Flammenprobe. Das Anion kann mittels Ringprobe oder Lunges Reagenz (siehe auch Nachweise für Anionen) nachgewiesen werden.
Einzelnachweise
- ↑ a b c d e f Datenblatt Bariumnitrat bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b Eintrag zu CAS-Nr. 10022-31-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. März 2011 (JavaScript erforderlich)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Bariumsalze“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
Kategorien:- Brandfördernder Stoff
- Gesundheitsschädlicher Stoff
- Nitrat
- Kubisches Kristallsystem
- Bariumverbindung
Wikimedia Foundation.






