- Mitsunobu-Reaktion
-
Die Mitsunobu-Reaktion ist eine organisch-chemische Reaktion um Alkohole in eine Reihe von funktionellen Gruppen zu überführen. Sie wurde von Oyo Mitsunobu (1934−2003) entdeckt und nach ihm benannt.[1]
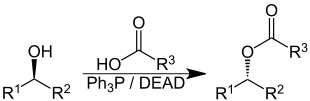
Sie ermöglicht die Transformation von Alkoholen zu Estern, Ethern, Aminen und Thioethern unter Verwendung der Reagenzien Triphenylphosphan und Diethylazodicarboxylat (DEAD) oder Diisopropylazodicarboxylat (DIAD).
Befindet sich die Hydroxygruppe an einem stereogenen Zentrum des Moleküls, reagieren solche sekundären Alkohole in der Mitsunobu-Reaktion unter Inversion am Stereozentrum. Auf diese Weise kann die Mitsunobu-Benzoylierung der Hydroxygruppe, gefolgt von der Hydrolyse des so gewonnenen Esters in der Naturstoffchemie zur gezielten Inversion sekundärer, chiraler Alkohole genutzt werden. In diesem Zusammenhang spricht man auch von einer Mitsunobu-Inversion.
Inhaltsverzeichnis
Mechanismus
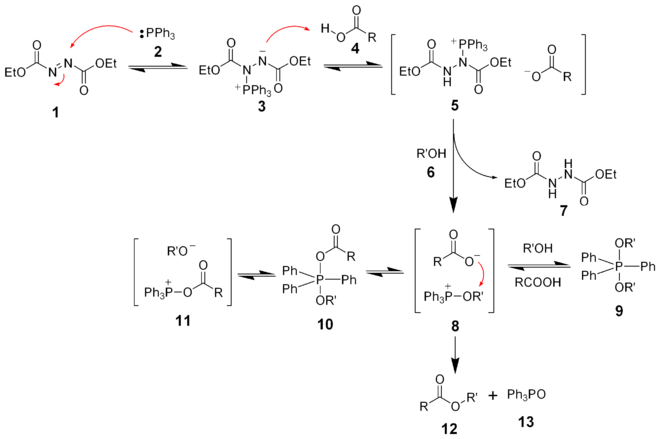
Im einleitenden Schritt greift das Triphenylphosphin das Diethylazodicarboxylat an und es entsteht als Zwischenstufe ein Betain. Dieses Betain deprotoniert die Carbonsäure und es wird ein Ionen-Paar gebildet. Der Alkohol greift nun diese Zwischenstufe an und es entsteht ein Alkohol-Triphenylphosphonium-Ion. Dieser wird nun von dem Carboxylat-Ion angegriffen und der Ester entsteht unter Abspaltung von Triphenylphosphinoxid. Die Triebkraft dieser Reaktion ist die Bildung der sehr stabilen Phosphor-Sauerstoff-Bindung.
Bei der Mitsunobu-Reaktion ist die Reihenfolge der Zugabe von Reagenzien wichtig. Üblicherweise wird der Alkohol, die Carbonsäure und das Triphenylphosphin in einem etherischen Lösungsmittel wie Diethylether oder Tetrahydrofuran (THF) gelöst und bei 0°C das Diazodicarboxylat zugegeben. Eine modernere Variante bei erfolglosen Mitsunobu-Reaktionen besteht aus einer Lösung des Diazodicarboxylates und Phosphin bei 0°C zu dem man nach einander den Alkohol und die Carbonsäure gibt.[2]
Varianten
Eine Reihe anderer funktioneller Gruppen können je nach Nucleophil auf die Weise aus Alkoholen hergestellt werden. Das Nucleophil muss dabei jedoch einen pKa-Wert von kleiner 15 besitzen.
Nucleophil Produkt Stickstoffwasserstoffsäure Alkylazide (nach Reduktion Amine) Imide Substituierte Imide[3] Phenole Phenylalkylether Sulfonamide Substituierte Sulfonamide [4] Weblinks
- The Mitsunobu Reaction von Kevin Jantzi
Literatur
- O. Mitsunobu: In "The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural Products," Synthesis 1981, 1-28.
- B.R. Castro: In Org. React. 1983, 29, 1.
- D.L. Hughes: In Org. React. 1992, 42, 335-656.
- D.L. Hughes: In Org. Prep. 1996, 28, 127-164.
Einzelnachweise
- ↑ O. Mitsunobu, Y. Yamada: In Bull. Chem. Soc. Japan 1967, 40, 2380-2382.
- ↑ R. Volante:In Tetrahedron Lett. 1981, 22, 3119.
- ↑ Hegedus, L. S.; Holden, M. S.; McKearin, J. M. Organic Syntheses, Coll. Vol. 7, p.501 (1990); Vol. 62, p.48 (1984).
- ↑ Kurosawa, W.; Kan, T.; Fukuyama, T. Organic Syntheses, Coll. Vol. 10, p.482 (2004); Vol. 79, p.186 (2002).
Wikimedia Foundation.