- Videx
-
Strukturformel 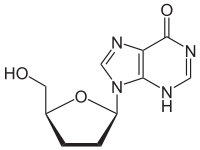
Allgemeines Freiname Didanosin Andere Namen - 2',3'-Dideoxyinosin (ddI)
- 9-[(2R,5S)-5-(Hydroxymethyl)oxolan-2-yl]-3H-purin-6-on
Summenformel C36H56O6 CAS-Nummer 69655-05-6 PubChem 50599 ATC-Code J05AF02
DrugBank DB00900 Kurzbeschreibung weißes bis fast weißes, kristallines Pulver [1] Arzneistoffangaben Wirkstoffklasse Virostatikum, nukleosidische Reverse-Transkriptase-Inhibitoren
Wirkmechanismus Fertigpräparate Videx® (A, CH, D)
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 236,23 g·mol−1 Schmelzpunkt 160–163 °C [2]
Löslichkeit wenig löslich in Wasser, leicht löslich in Dimethylsulfoxid, schwer löslich in Ethanol 96 % und Methanol [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 48/22 S: 22-36/37-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Didanosin (Handelsname Videx®; Hersteller Bristol-Myers Squibb) ist ein Arzneistoff zur Behandlung von mit HIV-1 infizierten Patienten im Rahmen einer antiretroviralen Kombinationstherapie.
Didanosin gehört zur Substanzklasse der nukleosidischen Reverse-Transkriptase-Inhibitoren.
Inhaltsverzeichnis
Pharmakologie
In vitro-Untersuchungen zeigten, dass Didanosin bei therapeutischen Konzentrationen, zu einer Hemmung der Replikation von HIV führt. Die Substanz zeigte nur geringe Wirkungen auf Stammzellen des Knochenmarks. Nach der Diffusion in die Zelle erfolgt die Umwandlung in Didesoxyadenosintriphosphat (ddATP), welches die biologisch aktive Form des Wirkstoffes darstellt, die mit dem physiologischen Substrat Desoxyadenosintriphosphat (dATP) kompetitiert. Es wurden keine Kreuzresistenz zu Zidovudin-resistenten Viren festgestellt.
Pharmakokinetik
Im Milieu des Magens ist Didanosin instabil. Die Zubereitung enthält Zusätze, die als Puffer wirken. Alternativ kann die Substanz zusammen mit Antazida eingenommen werden. Die Bioverfügbarkeit liegt dann bei ca. 40 %, bei enormer Variabilität. Die Einnahme erfolgt auf nüchternen Magen. Wenn zuvor Ranitidin gegeben wird, ist die Bioverfügbarkeit leicht höher. Andere werden nicht beeinflusst. Die Substanz wird mit einer Halbwertzeit von etwa einer Stunde ausgeschieden. Das biologisch relevante Triphosphat wird jedoch mit einer Halbwertzeit von ca. 12 Stunden eliminiert. Ein erheblicher Teil erscheint unverändert im Urin. Bei Patienten mit eingeschränkter Nierenfunktion ist die Halbwertzeit deutlich verlängert.
Klinik
Didanosin ist einer der ersten NRTIs. Es wird aufgrund seiner Nebenwirkungen und der mitochondrialen Toxizität nicht mehr in den üblichen Anfangskombinationen der antiretroviralen Therapie, sondern nur noch als spätere Therapieoption (Second-Line Kombination) eingesetzt
Nebenwirkungen
Am häufigsten sind Magen-Darm-Nebenwirkungen (Durchfall bei mehr als 10 % der Patienten, Übelkeit und Erbrechen bei bis zu 10 %). Dosisabhängig kann eine Pankreatitis auftreten (1–7 %), die tödlich verlaufen kann. Die gleichzeitige Gabe mit anderen Substanzen, die eine Pankreatitis verursachen können, ist deshalb zu vermeiden (z. B. Ribavirin). Häufig treten Kopfschmerzen und periphere neurologische Symptome wie Neuropathie auf (1–10 %).
Wechselwirkungen mit anderen Arzneimitteln
Auf Grund von Interaktionen sollte Didanosin u. a. nicht mit Stavudin, Tenofovir, Allopurinol oder Ribavirin eingenommen werden. Die Einnahme zum Essen reduziert die Bioverfügbarkeit.
Einzelnachweise
- ↑ a b c d Safety Data Sheet for DIDANOSINE CRS – European Pharmacopoeia (Ph. Eur. 6.2) 29. April 2009
- ↑ Didanosin bei DrugBank
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
