- Zinknitrat
-
Strukturformel Zn2+ 2 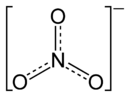
Allgemeines Name Zinknitrat Summenformel Zn(NO3)2 CAS-Nummer - 7779-88-6 (wasserfrei)
- 19154-63-3 (Tetrahydrat)
- 10196-18-6 (Hexahydrat)
Kurzbeschreibung farbloser, kristalliner Feststoff[1]
Eigenschaften Molare Masse 189,39 g·mol−1 Aggregatzustand fest
Dichte 2,065 g·cm−3 (Hexahydrat, 14 °C)[1]
Schmelzpunkt Löslichkeit sehr leicht löslich in Wasser: 1843 g·l−1 (Hexahydrat, 20 °C))
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

09 – Umweltgefährlich Gefahr
H- und P-Sätze H: 272-302-315-319-335-410 EUH: keine EUH-Sätze P: 273-302+352-305+351+338 [1] EU-Gefahrstoffkennzeichnung [1] 

Brand-
förderndGesundheits-
schädlich(O) (Xn) R- und S-Sätze R: 8-22-36/37/38 S: 26 LD50 1190 mg·kg−1 (oral Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zinknitrat [Zn(NO3)2] ist das Zinksalz der Salpetersäure.
Inhaltsverzeichnis
Gewinnung und Darstellung
Wasserhaltiges Zinknitrat entsteht bei der Reaktion von Zink mit Salpetersäure.
Dagegen lässt sich wasserfreies Zinknitrat nicht auf diese Weise gewinnen. Stattdessen ist es möglich dieses durch Reaktion von Distickstofftetroxid und Zink erhalten.
Eigenschaften
Zinknitrat ist ein farbloser brandfördernder Feststoff. Er zersetzt bei Erhitzung, wobei Stickoxide und Zinkoxid entstehen und vorher oberhalb von 105 °C Kristallwasser abgegeben wird.
[1] Von Zinknitrat sind mehrere Salze mit unterschiedlichen Mengen Kristallwasser bekannt. Das bekannteste enthält sechs Äquivalente Wasser, bekannt sind aber auch Hydrate mit zwei, vier oder neun Wassermolekülen.
Verwendung
Zinknitrat wird als Katalysator beim Knitterfestmachen von Textilwaren, als Bestandteil von Latex-Koagulierungsbädern, in der Galvanotechnik und der Acetatfaserfärbung verwendet.[1]
Es findet Verwendung als Bleich- und Beizmittel, sowie zur Gewinnung anderer Zinkverbindungen.
Einzelnachweise
Kategorien:- Gesundheitsschädlicher Stoff
- Brandfördernder Stoff
- Zinkverbindung
- Nitrat
Wikimedia Foundation.


