- Distickstofftetroxid
-
Strukturformel 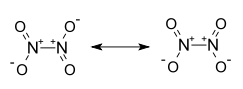
Allgemeines Name Distickstofftetroxid Andere Namen - Stickstofftetraoxid
- Stickstofftetroxid
- NTO
Summenformel N2O4 CAS-Nummer 10544-72-6 Kurzbeschreibung farbloses Gas[1]
Eigenschaften Molare Masse 92,01 g·mol−1 Aggregatzustand gasförmig (25°C)[1]
Dichte 1,45 g·cm–3[1]
Schmelzpunkt Siedepunkt 21,10 °C[1]
Dampfdruck Löslichkeit löslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 



Gefahr
H- und P-Sätze H: 270-330-314 EUH: keine EUH-Sätze P: 220-260-280-284-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Brand-
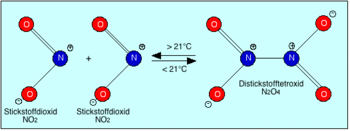
förderndSehr giftig (O) (T+) R- und S-Sätze R: 8-26-34 S: (1/2)-9-26-28-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Distickstofftetroxid, N2O4, ist bei 25 °C ein farbloses Gas. Es ist das Dimer des Stickstoffdioxids, NO2, und steht mit diesem in einem druck- und temperaturabhängigen Gleichgewicht.
Distickstofftetroxid wird unter seinem Trivialnamen Stickstofftetroxid, beziehungsweise meist unter der englischen Abkürzung NTO (von Nitrogen Tetroxide), in der Raumfahrt und Raketentechnik als ohne Kühlung lagerfähiges und hypergol mit Hydrazin und seinen Derivaten reagierendes Oxidationsmittel (Oxidator) verwendet.
Inhaltsverzeichnis
Eigenschaften
Distickstofftetroxid ist bei einer Temperatur von 25 °C und im reinen Zustand ein farbloses, ätzendes und stark oxidierend wirkendes Gas. Die kritische Temperatur für N2O4 beträgt 157,85 °C und der kritische Druck liegt bei 10 MPa. Das farblose, diamagnetische Distickstofftetroxid steht im Gleichgewicht mit dem rotbraunen, paramagnetischen Stickstoffdioxid. In der Gasphase zerfällt ein Molekül N2O4 in zwei Moleküle NO2.
Je nach Druck und Temperatur liegen unterschiedliche Anteile an beiden Gasen vor. Da Stickstoffdioxid ein rotbraunes Gas ist, ist Distickstofftetroxid meist braun gefärbt. Mit zunehmender Temperatur verschiebt sich das obige Gleichgewicht nach rechts und die braune Färbung vertieft sich. Bei 800 °C ist der Zerfall nahezu vollständig. Die Dissoziationskonstante kann hier über die konzentrationsproportionalen Partialdrücke wiedergegeben werden:[4]
Der Wert der Dissoziationskonstante hängt signifikant von der Temperatur ab.
T in °C 0 8,7 25 35 45 50 86,5 101,5 130,8 Kd[4] in atm 0,0177 0,0374 0,174 0,302 0,628 0,863 7,499 16,18 59,43 Beim Abkühlen kondensiert Distickstofftetroxid und die Flüssigkeit klart auf. In der Nähe des Siedepunktes zeigt die Substanz wegen noch gelöstem Stickstoffdioxid eine braune Färbung. N2O4 bildet farblose Kristalle. Auch die Variation des Druckes beeinflusst das Gleichgewicht. Eine Erhöhung des Druckes verschiebt es auf die rechte, eine Absenkung auf die linke Seite (Prinzip vom kleinsten Zwang).
N2O4 als auch NO2 bilden das gemischte Anhydrid der Salpetersäure und der Salpetrigen Säure. Mit Alkalihydroxidlösungen entstehen Nitrate und Nitrite, z. B:
Herstellung
Distickstofftetroxid ist das Dimer des Stickstoffdioxids, das als Zwischenprodukt bei der großtechnischen Salpetersäuresynthese durch Luftoxidation von Stickstoffmonoxid NO entsteht. Durch Abkühlen dimerisiert Stickstoffdioxid zu Distickstofftetroxid und kann so als Nebenprodukt in einer Salpetersäurefabrik produziert werden. Im Labor kann es analog gewonnen werden oder alternativ durch Reduktion von konzentrierter Salpetersäure mit Kupfer oder durch Erhitzen von Schwermetallnitraten wie Bleinitrat oder Silbernitrat im Sauerstoffstrom.
Verwendung
Distickstofftetroxid wird unter dem Trivialnamen Stickstofftetroxid seit den 1950er Jahren in vielen Raketen als ohne Kühlung lagerfähiges Oxidationsmittel (Oxidator) verwendet. Zusammen mit Hydrazinderivaten als Reduktionsmittel bildet es die einzigen bei Träger- und Interkontinentalraketen verwendeten hypergolischen Treibstoffmischungen. So wurde es z. B. zusammen mit Hydrazin und UDMH als Treibstoffgemisch (Aerozin 50) der Mondlandefähren und dem Apollo-Raumschiff im amerikanischen Apollo-Programm für Haupt- und Steuertriebwerke verwendet.
Zuerst wurde Distickstofftetroxid als lagerfähiger Oxidator bei den Interkontinentalraketen der zweiten Generation wie der Titan II verwendet, die dadurch immer vollgetankt und einsatzbereit auf ihren sofortigen Start warten konnten. Danach kam Distickstofftetroxid bei den aus diesen Interkontinentalraketen abgeleiteten Trägerraketen und zahlreichen neu entwickelten Trägerraketen bis heute zum Einsatz. Außerdem ist Distickstofftetroxid neben MON der Standardoxidator von Satelliten und Raumsonden.
Siehe auch
Quellen
- ↑ a b c d e f g Eintrag zu Distickstofftetroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7.2.2007 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 10544-72-6 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Nitrogen dioxide bei Sigma-Aldrich, abgerufen am 28. März 2011.
- ↑ a b J. Chao; R.C. Wilhoit; B.J. Zwolinski: Gas phase chemical equilibrium in dinitrogen trioxide and dinitrogen tetroxide in Thermochim. Acta 10 (1974) 359-371, doi:10.1016/0040-6031(74)87005-X.
Literatur
- Ralf Steudel, Chemie der Nichtmetalle, 3. Aufl., Walter de Gruyter, Berlin, New York 2008, ISBN 978-3-11-019448-7, Seite 345
Wikimedia Foundation.