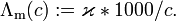- Äquivalentleitfähigkeit
-
Physikalische Größe Name Molare Leitfähigkeit Größenart Tensor Formelzeichen der Größe Λm Größen- und
Einheiten-
systemEinheit Dimension SI S·cm2·mol-1 I·t3·m−1·mol-1 Siehe auch: elektrischer Leitwert Die molare Leitfähigkeit ist für jede Ionenart in wässrigen Lösungen charakteristisch, sie ist auch direkt proportional der Wanderungsgeschwindigkeiten von Ionen bei einer Elektrolyse.
Aus Kenntnis der molaren Grenzleitfähigkeiten kann man vorausberechnen, welche elektrische Leitfähigkeit bestimmte Salze in Wasser haben sollten. Oder falls man nur die Salzsorte kennt, kann man aus einer Leitfähigkeitsmessung deren Konzentration bestimmen.
Die Kenntnis der molaren Grenzleitfähigkeiten von einzelnen Ionen ist auch bei der Elektrolyse wichtig. Mit der Kenntnis der molaren Grenzleitfähigkeiten können Wanderungsgeschwindigkeiten von Ionen während der Elektrolyse berechnet werden. Durch Leitfähigkeitsmessungen lässt sich auch der Stoffumsatz, die Überführungszahlen oder die Art der entstehenden oder umgesetzten Ionen bei Elektrolysen verfolgen.
Inhaltsverzeichnis
Molare Leitfähigkeit
Je mehr Salzionen sich in einer wässrigen Lösung befinden, desto besser leitet sie den elektrischen Strom. Oder anders ausgedrückt: Der elektrische Widerstand einer Lösung nimmt ab, je mehr Salzionen in ihr enthalten sind. Je nach chemischer Natur der Salzionen leiten einige Ionen den Strom sehr gut, andere Ionen schlechter. Der spezifische Widerstand ist ein von der Elektrodengröße und -abstand unabhängiger Widerstandswert einer Elektrolytlösung (Spezifischer Widerstand). Die spezifische Leitfähigkeit (Dimension: Ω − 1cm-1 = S * cm-1) ist der Kehrwert des spezifischen Widerstandes. In nicht sehr konzentrierten Lösungen (bis ca. 1 Mol/Liter) ist die spezifische Leitfähigkeit direkt der Salzkonzentration proportional. Trägt man die spezifische Leitfähigkeit eines bestimmten Salzes in Abhängigkeit von der Konzentration auf in einem Koordinatensystem auf, erhält man eine Gerade mit einer bestimmten Steigung.
Dividiert man die spezifischen Leitfähigkeitswerte bei den jeweiligen Konzentration durch die jeweilige Konzentration erhält man die sogenannte molare Leitfähigkeit (Λm, Dimension (früher) S·*cm2*mol-1). Es gilt:
Die Größe c ist die Konzentration des Salzes in dest Wasser(Dimension: Mol/Liter). Falls die neuen Dimensionsangaben benutzt werden, müssen die Werte entsprechend umgerechnet werden.
Die molare Leitfähigkeit hat je nach chemischer Natur des Salzes einen charakteristischen Wert, der noch leicht abhängig von der jeweiligen Konzentration ist.
Molare Grenzleitfähigkeit
Trägt man die molare Leitfähigkeit von verschiedenen Salzen in Abhängigkeit von der Wurzel aus der entsprechenden Konzentration in ein Koordinatensystem auf, erhält man Geraden, die die Ordinate an einem ganz bestimmten Punkt schneiden. Dieser Punkt ist die molare Grenzleitfähigkeit (Λ0) bei unendlicher Verdünnung. Dieser Punkt ist je nach Natur der Ionensorten eine ganz charakteristische Konstante. Der Punkt auf der Ordinate (der molaren Leitfähigkeit) nennt sich molare Grenzleitfähigkeit. Diese Beziehung gilt jedoch nur für starke Ionen (Cl-, SO42-, Na+). Für schwache Elektrolyte gilt das Ostwaldsche Verdünnungsgesetz. Die Beziehung für starke Elektrolyte wurde von Friedrich Wilhelm Kohlrausch gefunden und ist als Kohlrauschisches Quadratwurzelgesetz bekannt.
Es lautet:
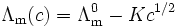
Für Λ0 gilt:
- Λ0 = ν +
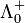 + ν −
+ ν − 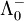
Dabei sind ν + , ν − die stöchiometrischen Faktoren entsprechend den Summenformeln und
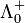 ,
, 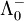 die Grenzleitfähigkeiten der einzelnen Ionen (Äquivalentleitfähigkeiten. Zur Ermittlung der molaren Grenzleitfähigkeit von Einzelionen kommt nur die molare Masse, die durch die Zahl der Ladungsträger des Ions dividiert (früher val) wird, in Betracht, so dass beispielsweise Lösungen mit unterschiedlichen stöchiometrischen Faktoren, wie beispielsweise von Natriumsulfat und Natriumchlorid, verglichen werden können.
die Grenzleitfähigkeiten der einzelnen Ionen (Äquivalentleitfähigkeiten. Zur Ermittlung der molaren Grenzleitfähigkeit von Einzelionen kommt nur die molare Masse, die durch die Zahl der Ladungsträger des Ions dividiert (früher val) wird, in Betracht, so dass beispielsweise Lösungen mit unterschiedlichen stöchiometrischen Faktoren, wie beispielsweise von Natriumsulfat und Natriumchlorid, verglichen werden können.Auch bisher unbekannte Grenzleitfähigkeiten von Ionen lassen somit leicht aus der Differnzbildung ermitteln.
Eine Verbesserung der Leitfähigkeitstheorie stellt das Debye-Hückel-Gesetz dar.
Ein Beispiel zur Ermittlung der molaren Leitfähigkeit aus Ionen-Grenzleitfähigkeiten
Für eine NaCl_Lösung ergibt sich anhand der unten angegebenen Tabelle eine molare Grenzleitfähigkeit von:
Λ0(NaCl)= 1*50,1 + 1*76,8 = 126,9 S·cm2mol-1.
Nach dem Beispiel hat eine 0,01 molare Natriumchloridlösung also etwa eine spezifische Leitfähigkeit von:
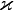 = 126,9 * 0,01 / 1000 S *cm-1= 0,001269 S *cm-1.
= 126,9 * 0,01 / 1000 S *cm-1= 0,001269 S *cm-1.Für sehr genauere Rechnungen benötigt man die Debye-Hückel-Onsager-Theorie.
Mit preisgünstigen Leitfähigkeitsmessgeräten kann man gegenwärtig sehr schnell und einfach wässrige Lösungen untersuchen.
Ionen-Grenzleitfähigkeiten zur Ermittlung von Überführungszahlen
Aus Kenntnis der Grenzleitfähigkeiten lassen sich auch die Wanderungsgeschwindigkeiten und damit die sogenannten Überführungszahlen von Ionen bei Elektrolysen ermitteln. Bei einer Elektrolyse wandern einige Ionen sehr schnell (z.B. H+, OH-) andere recht langsam (Li+, CH3COO-).
Für die Überführungszahlen von Kationen gilt: t+ = ν + *
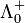 / Λ0.
/ Λ0.Für die Überführungszahlen von Anionen gilt: t- = ν − *
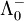 / Λ0.
/ Λ0.Es ist: t- + t+ = 1.
Eine hohe Überführungszahl ist also gleichbedeutend mit einer hohen Wanderungsgeschwindigkeit eines Ions. Durch verschiedene Wanderungsgeschwindigkeiten können sich bei einer Elektrolyse in einem Elektrodenraum bestimmte Ionen stärker ansammeln als in dem anderen Elektrodenraum. Dies lässt sich durch Leitfähigkeitsmessungen überprüfen.
Tabelle molare Grenzleitfähigkeiten von Ionen
Molare Grenzleitfähigkeiten von Ionen bei 298 K in dest. Wasser
Kation 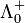 .(S·cm2mol-1)
.(S·cm2mol-1)Anion 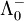 (S·cm2mol-1)
(S·cm2mol-1)H+ 349,8 OH- 198,6 Li+ 38,7 F- 55,4 Na+ 50,1 Cl- 76,8 K+ 73,5 Br- 78,1 Rb+ 77,8 I- 76,8 Ag+ 61,9 NO3- 71,5 NH4+ 73,6 ClO3- 64,6 N(C2H5)4+ 32,4 ClO3- 67,4 Mg2+ 53,1 HCO3- 44,5 Ca2+ 59,5 HCOO- 54,6 Ba2+ 63,6 CH3COO- 40,9 Cu2+ 56,6 0,5 SO42- 80,0 1/3 La3+ 69,7 0,5 CO32- 69,3 1/3 Ce3+ 69,8 1/3 Fe(CN)63- 100,9 Literatur
Gerd Wedler, Lehrbuch der Physikalischen Chemie, Verlag Chemie Weinheim 1982, S.193 ff
Siehe auch
Wikimedia Foundation.