- Äthan
-
Strukturformel 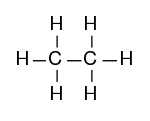
Allgemeines Name Ethan Andere Namen Äthan (standardsprachlich)
Summenformel C2H6 CAS-Nummer 74-84-0 PubChem 6324 Kurzbeschreibung farbloses Gas [1] Eigenschaften Molare Masse 30,07 g·mol−1 Aggregatzustand gasförmig
Dichte 1,36 g·l−1 (gasförmig, 0 °C, 1013 hPa) [1]
0,54 g/cm3 (flüssig, am Siedepunkt)[1]Schmelzpunkt −183 °C [1]
Siedepunkt −89 °C [1]
Dampfdruck Löslichkeit sehr schlecht in Wasser (24 µl/g bei 20 °C) [1], gut löslich in Ethanol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Hoch-
entzündlich(F+) R- und S-Sätze R: 12 S: (2)-9-16-33 WGK nicht wassergefährdend[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ethan (standardsprachlich: Äthan) ist eine chemische Verbindung, die den Alkanen zugehört (gesättigte Kohlenwasserstoffe). Es ist ein farb- und geruchloses Gas, das vor allem zu Heiz- und Verbrennungszwecken genutzt wird. Davon abgeleitet ist der Ethyl-Rest (C2H5–). Ethan ist neben Methan ein Hauptbestandteil des Erdgases.
Inhaltsverzeichnis
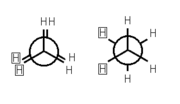
Konformation
Ethan weist zwei Konformationen auf, sie unterscheiden sich in ihrer Energie, die in diesem Fall als Torsionsenergie bezeichnet wird, um etwa 12,6 Kilojoule pro Mol. Während die ekliptische Konformation diese maximiert und daher instabil ist, wird sie von der gestaffelten Konformation minimiert, diese ist folglich energetisch bevorzugt. Alle anderen Konformationen liegen bezüglich ihrer Energie zwischen diesen beiden Extremen.
Die Torsionsenergie des Ethanmoleküls ist bei Raumtemperatur klein gegenüber der thermischen Energie, so dass es sich dann in konstanter Rotation um die C-C-Achse befindet. Allerdings „rastet“ es in regelmäßigen Abständen in der gestaffelten Konformation „ein“, so dass sich zu jedem Zeitpunkt etwa 99 Prozent aller Moleküle nahe dem Energieminimum befinden. Der Übergang zwischen zwei benachbarten gestaffelten Konformationen dauert aber nur durchschnittlich 10−11Sekunden. (siehe auch Konformation von Ethan).
Eigenschaften
Ethan ist ein farbloses und geruchloses Gas, es schmilzt bei −182,76 °C und siedet bei −88,6 °C. Es ist nur schlecht in Wasser löslich: 61 mg/l bei 20 °C. Zum Schmelzen werden 583 J/mol benötigt, zum Sieden 10 kJ/mol.
Struktur
- Bindungsabstand: C-C-Bindung 154 pm, C-H-Bindung 109 pm[3]
- Bindungswinkel: C-H-Bindung 109,5°, H-C-H-Bindung 109,5°
Vorkommen und Darstellung
Planet Ethananteil Jupiter 5,8 ± 1,5 ppm Saturn 7 ± 1,5 ppm Neptun ~1,5 ppm Im Erdgas sowie Sumpfgas finden sich nicht unerhebliche Mengen von Ethan, in der Atmosphäre finden sich allerdings nur Spuren. Die verhältnismäßig großen Mengen von Methan und Ethan auf der Erde sind vor allem auf dessen Lebensformen zurückzuführen bzw. der Zersetzung organischer Materie. Sie entstehen aber auch ohne das Beisein von Lebensformen in Anwesenheit von Wasserstoff und Kohlenstoff, da es sehr einfache Verbindungen sind.
Auf dem Jupiter, Saturn und Neptun finden sich Spuren von Ethan, auf den restlichen Planeten nicht. Auch auf manchen Kometen findet sich Ethan, so waren in der Koma des Kometen Hale-Bopp geringere Mengen Ethan zu finden. Die Ethanvorkommen im Weltall sind gering und viel kleiner als die des Methans. Auch auf einigen Monden findet sich Ethan: Auf dem Titan finden sich Spuren von Ethan, und am 30. Juli 2008 wurde bekanntgegeben das der See Ontario Lacus auf diesem Mond hauptsächlich mit Ethan gefüllt ist[4]. Auch auf dem Zwergplaneten Pluto findet sich Ethaneis.
Es kann im Labormaßstab durch Kolbe-Elektrolyse von Essigsäure beziehungsweise Kaliumacetat hergestellt werden.
Gefahren
Ethan führt beim Einatmen zu erhöhten Atem- und Herzfrequenzen. Des Weiteren führt es beim Einatmen in größeren Mengen zu Taubheit in den Gliedern, zu Schlaflosigkeit, mentaler Verwirrung, Koordinations- und Gedächtnisverlust sowie Hyperventilation. Bei Aufnahme führt es zu Übelkeit und Erbrechen. Weil Ethan meist bei tiefen Temperaturen flüssig gelagert wird, kann es bei austretendem Ethan zu Erfrierungen kommen. Ethan ist hochentzündlich.
Zwischen einem Luftvolumenanteil von 2,7 bis 15,5 Prozent bildet es explosive Gemische, wobei das zündwilligste Gemisch einen Anteil von 6,5 Vol-% Ethan enthält. Der Flammpunkt liegt bei −135 °C, die Zündtemperatur bei 515 °C.
Verwendung
Ethan wird mit dem Erdgas zu Heizzwecken in Feuerungsanlagen verbrannt, es hat einen Heizwert von 64 MJ/m3 (47 MJ/kg). Es dient auch als Ausgangsstoff für die Synthese von Ethen, Essigsäure und anderen chemischen Verbindungen. Außerdem wird Ethan als Kältemittel (R 170) in Kälte- und Klimaanlagen verwendet.
Reaktionen
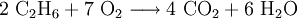
- Es verbrennt unter Idealbedingungen mit Sauerstoff zu Kohlenstoffdioxid und Wasser (Redoxreaktion).
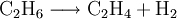
- Ethan wird zu Ethen und Wasserstoff gespalten.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 74-84-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 13. Januar 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 74-84-0 im European chemical Substances Information System ESIS
- ↑ J. L. Duncan, D. C. McKean and A. J. Bruce: Infrared spectroscopic studies of partially deuterated ethanes and the r0, rz, and re structures. In: Journal of Molecular Spectroscopy. 74, Nr. 3, Elsevier Inc., März 1979, S. 361–374 (doi:10.1016/0022-2852(79)90160-7).
- ↑ http://www.dlr.de/DesktopDefault.aspx/tabid-1/86_read-13154/ DLR: Saturnmond Titan - Ströme und Seen aus flüssigen Kohlenwasserstoffen
Weblinks
Wikimedia Foundation.