- Bombesin
-
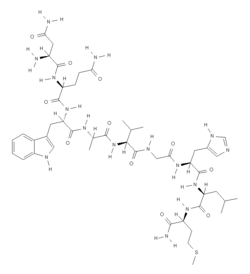
Bombesin (Bombina bombina) Strukturformel Masse/Länge Primärstruktur 14 Aminosäuren Bezeichner Externe IDs UniProt: P84214 Bombesin ist ein erstmals 1971 aus der Haut der Rotbauchunke (Bombina bombina) isoliertes Peptidhormon, das aus 14 Aminosäuren besteht und in ähnlicher Struktur als Gastrin Releasing Peptide (GRP) mit 27 Aminosäuren auch bei Menschen und Säugetieren nachgewiesen werden kann.
Primärstruktur
Primärstruktur: Pyr–Gln–Arg–Leu–Gly–Asn–Gln–Trp–Ala–Val–Gly–His–Leu–Met–CONH2.[1] (Modifikationen: N-Terminus: Glutamin → Pyroglutaminsäure, C-Terminus: Methionin → Methioninamid) (Pyr für Pyroglutaminsäure wird auch als pGlu abgekürzt)
Neun der letzten zehn Aminosäuren am C-terminalen Ende stimmen bei Bombesin und GRP überein und stellen den biologisch aktiven Anteil der Substanz und gleichzeitig das kürzeste Fragment dar, das an den GRP-Rezeptor binden kann. Beide gehören mit Neuromedin B zur Familie der bombesinähnlichen Peptide.
Bei der Chinesische Rotbauchunke (Bombina orientalis) gibt es mindestens drei verschiedene Formen von Bombesin, alle Agonisten mit unterschiedlicher Affinität für die bekannten Bombesin-Rezeptoren.[2] In der Haut von Bombina variegata wurde Bombesin zusammen mit anderen insulinotrope Peptiden gefunden.[3]
Ausblick
Da Tumorzellen vermehrt Neuropeptid-spezifische Rezeptoren aufweisen und sich Bombesin auch an der Entstehung von Brust- und Prostatakrebs beteiligt zeigte, wird derzeit nach metabolisch stabileren Bombesin-Analoga geforscht, die radioaktiv markiert sowohl in der Diagnostik als auch - als Radiopharmaka - zur gezielten Therapie verschiedener Malignome eingesetzt werden könnten.
Darüber hinaus hat sich gezeigt, dass Bombesin trotz seiner stimulierenden Wirkung auf die Gastrin- und Magensäureproduktion eine Substanz mit magenschützenden Eigenschaften sein könnte.[4]
Quellen
Wikimedia Foundation.