- Leucin
-
Strukturformel 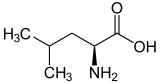
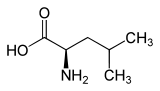
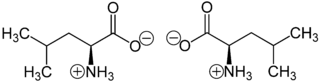
L-Leucin (links) bzw. D-Leucin (rechts) Allgemeines Name Leucin Andere Namen - 2-Amino-4-methyl-pentan-1-säure
- Abkürzungen:
- Leu (Dreibuchstabencode)
- L (Einbuchstabencode)
Summenformel C6H13NO2 CAS-Nummer - 61-90-5 (L-Enantiomer)
- 328-38-1 (D-Enantiomer)
PubChem 6106 ATC-Code V06[1]
DrugBank DB00149 Kurzbeschreibung schimmernd weiße Kristallschuppen[1]
Eigenschaften Molare Masse 131,18 g·mol−1 Aggregatzustand fest
Dichte 1,29 g·cm−3[2]
Schmelzpunkt pKs-Wert Löslichkeit - schlecht in Wasser (24 g·l−1 bei 20 °C)[1]
- unlöslich in Ethanol und Diethylether [1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Leucin, abgekürzt Leu oder L, ist eine proteinogene α-Aminosäure. Für höhere Lebewesen ist L-Leucin [Synonym: (S)-Leucin] eine essentielle Aminosäure, die vermutlich für den Energiehaushalt im Muskelgewebe eine zentrale Rolle spielt. Das Spiegelbildisomere (Synonym: Enantiomere) von L-Leucin ist das D-Leucin [Synonym: (R)-Leucin]. Letzteres kommt in Proteinen nicht vor. Leucin kristallisiert in weißen Plättchen, daher leitet sich auch der Name her (gr. λευκός: weiß).
In diesem Artikel betreffen die Angaben zur Physiologie allein die L-Leucin [Synonym: (S)-Leucin]. Wenn in diesem Artikel und in der wissenschaftlichen Literatur ohne jeden Zusatz „Leucin“ erwähnt wird, ist stets L-Leucin gemeint. Racemisches DL-Leucin [Synonym: (RS)-Leucin] und enantiomerenreine D-Leucin [Synonym: (R)-Leucin] sind synthetisch zugänglich und besitzen nur geringe praktische Bedeutung. Die Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung für fossiles Knochenmaterial – herangezogen werden.[4]
L-Leucin wird von den Codons UUA, UUG, CUU, CUC, CUA und CUG kodiert. Isoleucin, Norleucin und tert-Leucin sind Konstitutionsisomere.
Inhaltsverzeichnis
Eigenschaften
- Restname: Leucyl-
- essentiell: ja
- Seitenkette: lipophil
- van-der-Waals-Volumen: 124
- Hydrophobizitätsgrad: 3,8
Leucin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Leucin auch seine geringste Löslichkeit in Wasser hat. Der isoelektrischer Punkt liegt bei 5,98.[5] Racemisches Leucin, welches zum besseren Verständnis der Homochiralität in der Biosphäre zirkular polarisierter Synchrotron-Strahlung ausgesetzt wurde, zeigt einen Enantiomerenüberschuss von 2,6 %.[6]
Vorkommen
Leucin ist Bestandteil tierischen und pflanzlichen Proteins. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Leucin am Gesamtprotein angegeben:[7]
Lebensmittel Gesamtprotein Leucin Anteil Rindfleisch, roh 21,26 g 1691 mg 8,0 % Hähnchenbrustfilet, roh 23,09 g 1732 mg 7,5 % Lachs, roh 20,42 g 1615 mg 7,9 % Hühnerei 12,58 g 1088 mg 8,6 % Kuhmilch, 3,7 % Fett 3,28 g 321 mg 9,8 % Walnüsse 15,23 g 1170 mg 7,7 % Weizen-Vollkornmehl 13,70 g 926 mg 6,8 % Mais-Vollkornmehl 6,93 g 850 mg 12,3 % Reis, ungeschält 7,94 g 657 mg 8,3 % Erbsen, getrocknet 24,55 g 1760 mg 7,2 % Funktionen
L-Leucin ist wichtig für den Erhalt und Aufbau von Muskelgewebe. Es unterstützt die Proteinsynthese in Muskulatur und Leber, hemmt den Abbau von Muskelprotein und unterstützt Heilungsprozesse. Wie L-Isoleucin dient auch L-Leucin als Energielieferant. Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 10 bis 50 mg Leucin pro Kilogramm Körpergewicht.[8] Ein Mangel ist entweder durch ungenügende Zufuhr mit der Nahrung oder Unterversorgung mit Vitamin B6 bedingt.
Verwendung
Es ist wirksamer Bestandteil von Infusionslösungen. Im Kraftsport findet sie Verwendung in Supplementen zwecks Muskelaufbau.
Siehe auch
Einzelnachweise
- ↑ a b c d Holger Knapp, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Datenblatt Leucin bei Carl Roth, abgerufen am 8. Februar 2010.
- ↑ a b Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, S. Hirzel Verlag, Stuttgart 1991, ISBN 3-7776-0485-2, S. 823.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 62, 1982, ISBN 3-527-25892-2.
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Meierhenrich: Amino acids and the asymmetry of life, Springer-Verlag, 2008, ISBN 978-3-540-76885-2.
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 21. Auflage.
- ↑ A. V. Kurpad, M. M. Regan, T. Raj, J. V. Gnanou: "Branched-chain amino acid requirements in healthy adult human subjects", in: J. Nutr., 2006, 136(1 Suppl), S. 256S–263S; PMID 16365094.
Literatur
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 20. Auflage, S. Hirzel Verlag, Stuttgart, 1984, ISBN 3-7776-0406-2.
- Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2.
- Jesse Philip Greenstein und Milton Winitz: Chemistry of Amino Acids, John Wiley & Sons, 1962, Bände 1 bis 3, ISBN 0-471-32637-2.
- Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: "Production and Utilization of Amino Acids", Angewandte Chemie International Edition in English, 1978, 17, S. 176–183.
Weblinks
-
 Wikibooks: Biochemie und Pathobiochemie: Valin-, Leucin- und Isoleucin-Stoffwechsel – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Valin-, Leucin- und Isoleucin-Stoffwechsel – Lern- und Lehrmaterialien
 Proteinogene Aminosäuren
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Hydroxylysin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.