- Borkarbid
-
Strukturformel Keine Strukturformel vorhanden Allgemeines Name Borcarbid Andere Namen Schwarzer Diamant
Summenformel B4C CAS-Nummer 12069-32-8 Kurzbeschreibung glänzende schwarze Kristalle Eigenschaften Molare Masse 55,25 g/mol Aggregatzustand fest
Dichte 2,51 g/cm3[1]
Schmelzpunkt 2350 °C[1]
Siedepunkt >2500 °C[1]
Löslichkeit unlöslich in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20-36/37/38 S: 9-26-36/37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Borcarbid (Summenformel B4C) ist ein sehr hartes Material mit einer Mohshärte von 9,3, welches als verschleißbeständiges Material genutzt wird. Borcarbid wird häufig als Metallcarbid klassifiziert; dies ist sehr umstritten, da Bor kein Metall ist. Die Differenz der Elektronegativität zwischen Bor und Kohlenstoff ist deutlich kleiner als 1,5; somit sind im Unterschied zu den metallischen (Einlagerungs-)Carbiden wie zum Beispiel Titancarbid (TiC) kovalente Nichtmetall-Nichtmetall-Bindungen vorhanden.
Inhaltsverzeichnis
Gewinnung und Darstellung
Je nach Herstellungsprozess wird Borcarbid in Form eines feinen schwarzen Pulvers oder als grobe schwarzglänzende Kristalle erhalten.
Das grobkristalline Borcarbid wird erhalten bei der Herstellung aus Bortrioxid und Kohlenstoff im elektrischen Widerstandsofen bei 2400 °C:
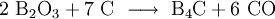
- Herstellung von grobkristallinem Borcarbid
Das feinkristalline Pulver erhält man bei der Reduktion von Bortrioxid mit Magnesium in Gegenwart von Kohlenstoff: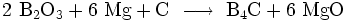
- Herstellung von pulverförmigem Borcarbid
Eigenschaften
Physikalische Eigenschaften
Borcarbid ist eine Nichtoxid-Keramik, die sich ähnlich wie Siliciumcarbid oder Siliciumnitrid durch besondere Härte und Zähigkeit auszeichnet. Borcarbid-Keramik ist sehr verschleißbeständig bei niedrigen Temperaturen. Sie sind in Hinsicht auf ihre Härte sogar verschleißbeständiger als Siliciumnitrid-Keramiken, jedoch nur bei niedrigen Temperaturen, siehe unten.
Verschleißmechanismus
Der Verschleiß durch Schlag oder Reibung erfolgt herkömmlich, indem durch mechanische Energie Teile des Gefüges herausgebrochen werden. In dieser Hinsicht ist Borcarbid der ideale Werkstoff, da er der härteste Werkstoff ist, welcher synthetisch ökonomisch hergestellt werden kann. Alternativ wären Siliciumnitrid oder Siliciumcarbid als harte, verschleißbeständige Materialien zu wählen. Borcarbid schützt sich selbst gegen Oxidation (Passivierung), indem die Oberfläche des Materials mit Sauerstoff wie folgt reagiert:
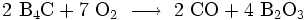 bzw.
bzw.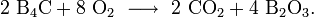
Bei der Reaktion ist die Temperatur zu beachten, da in Folge des Boudouard-Gleichgewichtes Kohlenstoffmonoxid oder Kohlenstoffdioxid gebildet werden kann. Das gebildete Bortrioxid ist ein Festkörper, welcher bereits bei 450 °C schmilzt, wenn es kristallin ist, sonst (amorph, glasig) schon früher. Die Schmelze hindert den Sauerstoff daran, weiter in die Matrix einzudringen, so dass die Oxidation der Matrix gestoppt wird. Das Problem ist, dass bei Verschleißanwendungen häufig wesentlich höhere Temperaturen als 450 °C erreicht werden, bei welchen Bortrioxid dünnflüssig ist. Hierdurch kann Luftsauerstoff leichter durch die Bortrioxidschmelze diffundieren. Bei der Oxidation von Siliciumnitrid oder Siliciumcarbid entsteht bei Oxidation Siliciumdioxid, welches wesentlich zäher ist, so dass Luftsauerstoff langsamer durch die Schmelze diffundiert. Siliciumnitrid oder Siliciumcarbid sind somit wesentlich oxidationsbeständiger.
Chemische Eigenschaften
Borcarbid ist ein chemisch sehr inertes Material. Es wird erst oberhalb von 1000 °C von Chlor oder Sauerstoff merklich angegriffen. Gegen Fluorwasserstoff und heiße Salpetersäure ist es vollkommen beständig.
Verwendung
- Panzerungsmaterial
- als Schneidstoff in der Werkzeugbearbeitung
- Neutronenabsorber in Kernkraftwerken
- Werkstoff für Sandstrahldüsen
Quellen
Wikimedia Foundation.


