- Botulinum-Toxin
-
Botulinumtoxin Serotyp A (Clostridium botulinum) Bändermodell nach PDB 3BTA Vorhandene Strukturdaten: siehe UniProt-Eintrag Größe 447+848 AS (L+S) Struktur Heterodimer L+S Kofaktor Zn2+ Precursor 1296 Aminosäuren; 146 kDa Bezeichner Gen-Name(n) BoNT/A Externe IDs UniProt: P10845 CAS-Nummer: 93384-43-1 Arzneistoffangaben ATC-Code M03AX01 DrugBank DB00083 Wirkstoffklasse Muskelrelaxans Handelsnamen - Botox®
- Vistabel®
- Dysport®
- Xeomin®
Verschreibungspflicht Ja Transporter-Klassifikation TCDB 1.C.8 Bezeichnung Botulinum/Tetanus Toxinfamilie Enzymklassifikation EC, Kategorie 3.4.24.69 Metalloprotease MEROPS M27.002 Reaktionsart Hydrolyse Substrat Proteine der Neuroexocytose, Synaptobrevine, Syntaxine Produkte Spaltprodukte Vorkommen Homologie-Familie Botulinumtoxin Übergeordnetes Taxon Clostridium Botulinumtoxin, auch Botulismustoxin, Botulinustoxin, Botulin, Handelsname Botox®, ist ein neurotoxisches Protein und ein pharmakologisch hochwirksames Exotoxin, welches auf neuronaler Ebene – insbesondere bei der Signalübertragung vom Gehirn zu den Muskeln – im Körper wirkt. Das Toxin wird von dem Bakterium Clostridium botulinum ausgeschieden. Während insbesondere früher das C. botulinum als Lebensmittelvergifter (Botulismus) sehr gefürchtet war, wird das von ihm erzeugte Protein heutzutage auch zu medizinischen Zwecken eingesetzt. Das Botulinumtoxin stellt eines der stärksten bekannten Gifte dar. Die LD50-Werte reichen von 30 pg/kg (Maus, intravenös) bis 4 ng/kg (Maus, subkutan).[1]
Strukturell ähnlich aufgebaut ist das Tetanustoxin, welches von C. tetani produziert wird. C. botulinum kommt ubiquitär vor allem im Erdboden vor.
Inhaltsverzeichnis
Chemischer Aufbau
Botulinumtoxine stellen hochmolekulare Proteinkomplexe dar, die sich aus dem eigentlich paralytisch wirkenden Neurotoxin sowie weiteren nichttoxischen Komplexproteinen (Hüllproteinen) bakteriellen Ursprungs zusammensetzen. Die Komplexproteine schützen das Neurotoxin vor dem proteolytischen Abbau im sauren Milieu des Magens nach oraler Applikation, so dass dieses biologisch verfügbar ist und Vergiftungen auslösen kann. Der Komplex dissoziiert jedoch bei neutralem pH-Wert des Gewebes und ist nicht mehr stabil. Ebenfalls instabil wird das Protein bei Erhitzung. Bei der therapeutischen Applikation des Botulinumtoxins haben die Komplexproteine daher keine wesentliche Funktion und tragen nicht zur Wirksamkeit bei. Diskutiert wird allerdings, ob Unterschiede in der klinischen Wirksamkeit der zugelassenen Medikamente (zum Beispiel die Diffusionskapazität/Wanderungsfähigkeit) auf die unterschiedlichen Arten der vorhandenen Hüllproteine zurückzuführen sein können. Man unterscheidet bisher die Serotypen A bis F, von denen A und B medizinisch genutzt werden.
Wirkungsmechanismus
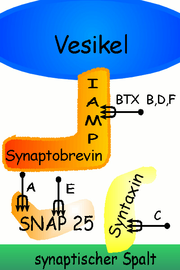
Botulinumtoxin hemmt die Erregungsübertragung von den Nervenzellen zum Muskel, wodurch die Kontraktion des Muskels je nach Dosierung des Gifts schwächer wird oder ganz ausfällt. Botulinumtoxin besteht aus zwei Untereinheiten, die mit A und B gekennzeichnet sind. Die Untereinheit A ist verantwortlich für die Spezifität des Giftes. Mit ihrer Hilfe dockt das Botulinumtoxin gezielt am präsynaptischen Teil der neuromuskulären Endplatte an. Durch Endocytose wird das Gift in die synaptische Endigung aufgenommen. Hier spaltet sich die Untereinheit B von dem Gift ab. Diese Untereinheit wirkt als Zink-Endopeptidase und ist in der Lage, verschiedene Proteine des Vesikelfusions-Apparates zu spalten und damit die Exocytose der Vesikel zu verhindern. Das Membranprotein Synaptobrevin, das ein essentieller Bestandteil der sekretorischen Vesikel ist, wird bereits durch die Anwesenheit eines einzigen Botulinumtoxinmoleküls auf Grund der katalytischen Wirkung fortwährend aufgespalten, und zwar ohne dass sich das Botulinumtoxin dabei selbst verbraucht. Dieser Vorgang setzt sich solange fort, bis die betroffene Nervenzelle zerstört ist und die angebundene Muskelfaser irreversibel nicht mehr angesteuert werden kann. Diese kann dann nur durch Neubildung von Nervenzellen reaktiviert werden. Die synaptischen Vesikel können nicht mehr mit der Membran fusionieren und ihren Transmitter Acetylcholin nicht mehr in den synaptischen Spalt ausschütten. Dadurch kommt es zu einer Lähmung des Muskels, an dem das Gift wirkt. Es gibt unterschiedliche Arten (Subtypen) von Botulinumtoxin, die unterschiedliche, an der Impulsübertragung beteiligte Proteine zerstören (siehe Grafik).
Kennzeichen des Botulismus beim Menschen
Die ersten Erscheinungen der als Botulismus bezeichneten Vergiftung treten nach 5–15 h auf und umfassen in der Regel Übelkeit, Kopfschmerzen und Mundtrockenheit. Nach einigen Stunden folgen erste Muskellähmungen. Insbesondere die Lähmung der Augenmuskulatur (Doppeltsehen) und die Lähmung der Nackenmuskulatur (Halssteifigkeit) sind deutliche Hinweise auf Botulismus. In diesem Stadium der Vergiftung kann eine Bekämpfung mit Antitoxin noch möglich sein. Der Tod tritt durch Atemlähmung ein.
Herkunft der Bezeichnung Botulinum
Der Botulismus wurde 1817 vom schwäbischen Arzt und Dichter Justinus Kerner das erste Mal wissenschaftlich beschrieben. Der Name Botulinumtoxin ist von dem lateinischen Wort botulus „Wurst“ abgeleitet. Grund für diese Ableitung ist, dass früher Erkrankungen, die mit dem Botulinumtoxin assoziiert waren, häufig in Verbindung mit Wurstkonserven anzutreffen waren. Clostridium botulinum als Bakterium, welches den Botulismus verursacht, ist ubiquitär als Spore anzutreffen. Das Bakterium benötigt nichtsaure, extrem sauerstoffarme Milieubedingungen, um auszukeimen und das Toxin zu produzieren. Solche Bedingungen sind in Wurstkonserven meist gegeben, zudem gilt Fleisch meist als exzellentes Substrat für das Wachstum von Mikroorganismen. Da früher die Sterilisierungstechnik nicht weit entwickelt war, kam es immer wieder vor, dass Sporen von Clostridum botulinum das „Konservieren“, also Erhitzen der Konserven überlebten und während der Lagerung der Konserve mit entsprechenden Folgen auskeimten. Heutzutage wird bei kritischen Produkten der sogenannte Botulinum-Cook (12-facher D-Wert) durchgeführt. Damit werden auch Sporen zuverlässig abgetötet.
Lebensmittelvergiftung durch Botulinumtoxin
Gefährdete Lebensmittel
In erster Linie sind Lebensmittel gefährdet, die unter anaeroben Bedingungen gelagert sind und deren Milieu nur schwach sauer oder neutral ist (pH > 4,5). Begünstigt werden kann die Bildung des Toxins durch geringen Salzgehalt und Lagertemperaturen > 5 °C, wobei letzteres bei Konserven in der Regel gegeben ist. C. botulinum stellt zudem hohe Nährstoffansprüche und benötigt daher ein komplexes Nährmedium. Klassischerweise gefährdet sind demnach Fleisch- und Fischkonserven, Mayonnaise, aber auch schwachsaure Frucht- oder Gemüsekonserven. Nicht gefährdet sind bei den Fleischprodukten hingegen (stark) gepökelte Produkte, da das im Pökelsalz enthaltene Nitrit C. botulinum im Wachstum hemmt.
Kennzeichen einer Botulinumvergiftung eines Produkts
Ein wichtiges Indiz bei Konserven ist die Bombage (auch Bombierung): Die Konservendeckel wölben sich durch den entstandenen Innendruck nach außen. Entweichende Gase beim Öffnen eingemachter Produkte deuten ebenfalls auf eine Vergiftung hin, was in den meisten Fällen auch mit einem ekelhaften Geruch einher geht. Solche Konserven sollten sofort entsorgt werden. Besteht Unsicherheit, ob die beschriebenen Kennzeichen zutreffen, ist es empfehlenswert, aus Sicherheitsgründen den Konserveninhalt einige Minuten (15–20 gelten als sicher) durchzukochen. Als hitzelabiles Toxin wird das Botulinumtoxin dadurch inaktiviert.
Maßnahmen zur Vermeidung der Entstehung des Toxins
Im Haushalt bei der Herstellung von Konserven oder beim Einmachen:
- Produkt ausreichend säuern (pH < 4,5)
- Produkt salzen
- Konserven bei tiefen Temperaturen lagern (bestens < 5 °C)
- Ausreichend lange einkochen oder sterilisieren, möglicherweise zweimal erhitzen
- Ausreichend pökeln
Insbesondere die Säuerung ist ein wichtiges Mittel, um C. botulinum zu inaktivieren. Mit einer sorgfältig und ausreichend lange durchgeführten Sterilisation können die Sporen ebenfalls sicher abgetötet werden. Trifft keiner der genannten Maßnahmenpunkte zu, so kann ein Produkt dennoch sicher haltbar sein, da sich die verschiedenen Maßnahmen synergistisch verstärken (können).
In der Industrie:
- Allgemeine Regeln der Arbeitshygiene beachten
- Möglichst wenig verunreinigte Rohware verwenden
- Umsetzung des 12D-Konzepts (Sterilisation über den 12-fachen D-Wert)
Therapeutische Anwendung
Anwendungsfelder
In der Neurologie wird Botulinumtoxin seit Anfang der 80er Jahre als zugelassenes Arzneimittel in erster Linie in der Behandlung von speziellen Bewegungsstörungen, den sog. Dystonien (eine Zulassung besteht prinzipiell nur für den rotierenden Torticollis spasmodicus (Botox, Dysport, Xeomin und Neurobloc)), Schielen oder Lidkrämpfen eingesetzt. Behandelt werden in der Regel Patienten mit segmentalen oder fokalen Dystonien (z. B. auch der sog. Schreibkrampf). Darüber hinaus besteht eine Zulassung für die Behandlung des Blepharospasmus (Botox, Dysport und Xeomin), des Spasmus hemifacialis (Botox und Dysport), einer Bewegungsstörung nach peripherer Affektion des N. Facialis sowie bei bestimmten spastischen Syndromen bei Erwachsenen und Kindern, beispielsweise beim spastischen Spitzfuß bei Patienten mit Cerebral Parese (CP) (Botox), bei der Armspastik nach Schlaganfall (Dysport) bzw. bei fokaler Spastik von Hand und Handgelenk nach Schlaganfall (Botox). Auch als Arzneimittel zur Behandlung übermäßigen Schwitzens (Botox) ist es in Deutschland zugelassen. Angewendet werden kann es prinzipiell auch bei erhöhter Speichelproduktion (z. B. bei Patienten mit M. Parkinson oder Amyotropher Lateralsklerose).
Weitere Anwendungsgebiete:
- In der kosmetischen Medizin zur Behandlung mimisch bedingter Falten
Die Anwendung des Medikamentes BOTOX gegen Falten ist inzwischen so weit verbreitet und durch Massenmedien bekannt gemacht worden, dass sich der Begriff „Botoxbehandlung“ unabhängig von der genauen Bezeichnung des verwendeten Medikamentes metonymisch als Begriff für das Therapieverfahren durchgesetzt hat.
- In der Schmerztherapie (bei Kopfschmerz und Schmerzzuständen der Muskulatur)
- Bei der Therapie der Achalasie, einer Speiseröhrenengstellung
- Bei Hyperhidrose, übermäßigem Schwitzen
- Experimentell bei einzelnen Patienten mit einer Sphincter-oddi-Dysfunktion (SOD)
- zahlreiche weitere Anwendungsgebiete sind in der Erprobung, z. B. urologische Erkrankungen, orthopädische Krankheiten, dermatologische Probleme
- Ein gutes Beispiel für den Einsatz von Botulinumtoxin sind die Studien zum Einsatz von Botulinumtoxin bei chronischen Spannungskopfschmerzen. Hier war die Responderrate sogar 70 %, allerdings war die Responderrate für die Injektion von Botulinumtoxin in Nacken- und Kopfmuskeln genau so hoch wie bei der Injektion von isotonischer Kochsalzlösung. Auch dies ist wiederum ein Beispiel dafür, dass invasive Verfahren einen deutlich höheren Plazeboeffekt haben als medikamentöse Therapien. [2][3]
Wirkmechanismus
Botulinumtoxin A (Handelsnamen Botox, Dysport, Xeomin) ist ein natürlich vorkommendes Bakterieneiweiß. Wird es in einen Muskel gespritzt, so blockiert es dort gezielt die Nervenimpulse (Blockierung der ACh-Freisetzung, siehe oben). Dadurch kann der entsprechende Muskel nicht mehr wie gewohnt angespannt werden. Andere Nervenfunktionen – wie das Fühlen oder Tasten – werden nicht beeinflusst. Nach einer therapeutischen Injektion baut sich die Wirkung langsam auf und erreicht nach etwa zehn Tagen ihren Höhepunkt. Nach etwa drei Monaten ist die Neuaussprossung der Nervenenden beendet, wodurch die Muskeln wieder aktiviert werden können. Die Injektion kann mit gleichzeitiger Messung eines Elektromyogrammes (EMG) im Muskel, der so genannten Stimulationstechnik, ultraschallgesteuert oder nach anatomischer Kenntnis erfolgen. Es gibt eine Anzahl von Patienten mit Nerven-Muskelkrankheiten, bei denen der Körper nach vorhergehender langer und hochdosierter Anwendung neutralisierende Antikörper gegen den Subtyp A bildet; die Wirksamkeit der Medikamente nimmt dadurch ab oder geht ganz verloren. Andere Subtypen spielen zur Zeit im medizinischen Alltag keine Rolle, beispielsweise Typ B (Neurobloc, Zulassung 2001 gegen Schiefhalssyndrom), das allerdings eine deutlich kürzere Wirkungsdauer hat.
Da Botulinumtoxin ein starkes Gift ist, wird jede Produktionseinheit an Mäusen getestet. Die Substanz wird Gruppen von Mäusen in verschiedenen Verdünnungen in die Bauchhöhle injiziert, um die Dosis zu ermitteln, bei der die Hälfte der Tiere durch Atemlähmung stirbt.
Zugelassene Medikamente mit Botulinumtoxin als Wirkstoff
Angeboten wird das Botulinumtoxin Typ A in Deutschland als Medikament von drei verschiedenen Firmen:
- Botox und Vistabel der Firma Allergan
- Dysport der Firma Ipsen
- Xeomin der Firma Merz
Das dabei wohl bekannteste und am besten untersuchte Arzneimittel ist Botox der Firma Allergan. Dieses Präparat ist in Deutschland für eine Vielzahl von Anwendungen zugelassen.
Seit 2005 ist Xeomin zugelassen. Es handelt sich um das einzige Botulinumtoxin-Präparat mit dem reinen Botulinum Neurotoxin Typ A.
Seit 2006 ist in Deutschland Vistabel für Anwendungen im kosmetischen Bereich zugelassen.
Überdosierung
Bei einer Überdosierung, oder wenn das Toxin in die Blutbahn gelangt, steht ein polyvalentes Botulismus-Antitoxin vom Pferd zur Verfügung. Es gehört in größeren Krankenhäusern zum Notfalldepot. Meist erfolgt die intravenöse Injektion aber zu spät, um eine sofortige und vollständige Erholung zu ermöglichen. Eine künstliche Beatmung über längere Zeit ist unabdingbar.
Botulinumtoxin als Biowaffe
Das Botulinumtoxin kann aus militärischer Sicht auch als Biowaffe eingesetzt werden. Da Botulinumtoxin an der Luft schnell zu unschädlichen Stoffen zerfällt, könnte ein mit Botulinumtoxin vergiftetes Gebiet schon nach ein bis zwei Tagen wieder gefahrlos betreten werden. Nach Ansicht von Edwin Chapman (University of Wisconsin-Madison) gehört das Botulinumtoxin zu den gefährlichsten Biowaffen.[4] Wegen dieses Missbrauchspotentials müssen Pharmafirmen auch stets das Kriegswaffenkontrollgesetz berücksichtigen.[5]
Aufsehen erregte die gegen den Willen der US-Regierung veröffentlichte Studie von Wein/Liu, der zufolge es Terroristen möglich wäre, durch das unbemerkte Einbringen einer Botulinumtoxin-Menge im Grammbereich in die Milchversorgung mehrere hunderttausend Menschen zu vergiften und einen erheblichen Anteil auch zu töten. Allerdings ist die Herstellung solcher Mengen des Toxins mit einem erheblichen Geld-, Material- und Zeitaufwand verbunden und dürfte für Terroristen ohne staatliche Basis kaum zu bewerkstelligen sein. Das übliche Botox für medizinische Anwendungen ist derartig stark verdünnt, dass damit niemand ohne weiteres getötet werden kann.[6] Omu Shinrikyo hatte die Verwendung von Botulinumtoxin für ihre Anschläge erwogen, kam aber wegen des zu hohen Aufwands davon wieder ab und setzte letztlich Sarin ein.[7]
Quellen
- ↑ Botulinumtoxin bei ChemIDplus
- ↑ Hans-Christoph Diener (2006): Heilung der Migräne durch Schönheitschirurgen. In: Akt. Neurol. Bd. 33, S. 531-532. doi:10.1055/s-2006-951881
- ↑ Silberstein, S.D. et al. (2006): Botulinum toxin type A in the prophylactic treatment of chronic tension-type headache: a multicentre, double-blind, randomized, placebo-controlled, parallel-group study. In: Cephalalgia. Bd. 26, S. 790-800. PMID 16776693
- ↑ [1] Howard Hughes Medical Institute "The deadliest of all substances, botulinum toxin is considered a bioterrorist threat."
- ↑ [2] Anlage, Biologische Waffen
- ↑ [3] Federation of American Scientists "Got milk?"
- ↑ [4] Center for Defense Information, "Aum Shinrikyo"
Weblinks
- Gift der Gifte: Das Botulinum-Toxin (Dr. Bernhard Peter)
- Pro und contra, Risiken bei der Faltentherapie
- Therapie der fokalen Dystonien mit Botulinum-Neurotoxin
- Häufige Fragen zu Botulinumtoxin Typ A: Deutsche Gesellschaft für Ästhetische Botulinumtoxin-Therapie (DGBT)
- Botox und Tierversuche, Ärzte für Tierschutz
Wikimedia Foundation.