- Azomethan
-
Strukturformel 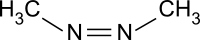
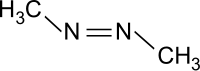
cis- (oben) bzw. trans-Azomethan (unten) Allgemeines Name Azomethan Andere Namen - Dimethyldiimid
- 1,2-Dimethyldiazen
Summenformel C2H6N2 CAS-Nummer 503-28-6 Azomethan
4143-41-3 trans-Azomethan
4143-42-4 cis-AzomethanPubChem 10421 Kurzbeschreibung farbloses bis schwach gelbes Gas
Eigenschaften Molare Masse 58,082 g·mol−1 Schmelzpunkt -78 °C[1]
Siedepunkt 1,5 °C[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Azomethan ist ein farbloses bis schwach gelbliches explosives Gas und die einfachste organische Azoverbindung. Es existieren zwei Isomere:
- cis-Azomethan, nach IUPAC: (Z)-Azomethan
- trans-Azomethan, nach IUPAC: (E)-Azomethan.
Das trans-Isomere ist um 42 kJ/mol stabiler als die cis-Verbindung.[3] Bei Temperaturen oberhalb von 0 °C tautomerisiert Azomethan zu Formaldehyd-Methylhydrazon (CH3NHN=CH2).[4]
Inhaltsverzeichnis
Gewinnung und Darstellung
Azomethan lässt sich aus 1,2-Dimethylhydrazin durch vorsichtige Oxidation, beispielsweise mit Kupfer(II)-chlorid, in guter Ausbeute herstellen.[5]
Biologische Bedeutung
Beim Metabolismus des stark krebserregenden 1,2-Dimethylhydrazin entsteht Azomethan durch Oxidation in der Leber als Zwischenprodukt.[6]
Verwendung
Die schwierige Handhabung der Verbindung steht einer größeren technischen Anwendung entgegen. Im Labor kann Azomethan zur Erzeugung von Methylradikalen verwendet werden.[7] Bei der Pyrolyse bilden sich neben dem thermodynamisch sehr stabilen Stickstoff kurzzeitig zwei Methylradikale.
 •
•
Einzelnachweise
- ↑ a b Azomethan Lexikon der Chemie
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ I. Vrabel u. a.: Stationary Points on the Ground-State Potential Energy Surface of Dimethyldiazene. Isomerization and Decomposition in Competition. In: J Phys Chem 101, 1997, S. 5805–5812. doi:10.1021/jp970702j
- ↑ M. N. Ackermann u. a.: Vibrational Spectra of cis-Dimethyldiazene-d0 -1,1,1-d3, and -d6. In: J Phys Chem 83, 1979, S. 1190–1200. doi:10.1021/j100472a017
- ↑ Francis P. Jahn: The Preparation of Azomethane. In: JACS 59, 1937, S. 1761–1762. doi:10.1021/ja01288a502
- ↑ S. Wolter und N. Frank: Metabolism of 1,2-dimethylhydrazine in isolated perfused rat liver. In: Chem Biol Interact 42, 1982, S. 335–244. PMID 7151235
- ↑ R. S. Zhai u. a.: Chemisorption and reaction characteristics of methyl radicals on Cu(110). In: Langmuir 20, 2004, S. 3623–2631. PMID 15875392
Literatur
- K. Wolter: Schwingungsspektroskopische Untersuchungen an einem Übergangsmetalloxid/Metall-Modell-Katalysatorsystem. Dissertation, TU Berlin, 2001.
- K. S. Khuong und K. N. Houk: One-bond, two-bond, and three-bond mechanisms in thermal deazetizations of 2,3-diazabicyclo[2.2.2]oct-2-enes, trans-azomethane, and 2,3-diazabicyclo[2.2.1]hept-2-ene. In: JACS 125, 2003, S. 14867–14883. PMID 14640664
- E. W. Diau und A. H. Zewail: Femtochemistry of trans-azomethane: a combined experimental and theoretical study. In: Chemphyschem 4, 2003, S. 445–456. PMID 12785258
- P. Cattaneo und M. Persico: Semiclassical simulations of azomethane photochemistry in the gas phase and in solution. In: JACS 123, 2001, S. 7638–7645. PMID 11480986
- N. J. Gerria und F. Kaufman: The explosive decomposition of azomethane. In: Symposium (International) on Combustion 10, 1965, S. 227–235. doi:10.1016/S0082-0784(65)80167-9
- O. K. Rice: The Theory of the Decomposition of Azomethane. In: PNAS 14, 1928, S. 118–124. PMC 1085389
Wikimedia Foundation.
