- Tropolone
-
Tropolone Name α-Tropolon β-Tropolon γ-Tropolon Andere Namen 1,2-Tropolon,
2-Hydroxycyclohepta-2,4,6-trienon
Purpurcatechol
2-Hydroxytropon1,3-Tropolon
3-Hydroxytropon1,4-Tropolon
4-HydroxytroponStrukturformel 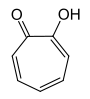
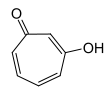
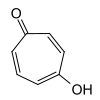
CAS-Nummer 533-75-5 3324-76-3 4636-39-9 ? (Isomerengemisch) PubChem 10789 ??? 20751 Summenformel C7H6O2 Molare Masse 122,12 g·mol−1 Aggregatzustand fest Kurzbeschreibung hellgelber Feststoff[1] Schmelzpunkt 50–52 °C[1] Siedepunkt 80–84 °C[1] Löslichkeit löslich in Wasser GHS-
Einstufungkeine GHS-Piktogramme keine Einstufung verfügbar keine Einstufung verfügbar H- und P-Sätze keine H-Sätze siehe oben siehe oben keine EUH-Sätze keine EUH-Sätze keine EUH-Sätze keine P-Sätze siehe oben siehe oben Gefahrstoff-
kennzeichnung
[1]keine Gefahrensymbole keine Einstufung verfügbar keine Einstufung verfügbar R-Sätze keine R-Sätze siehe oben siehe oben S-Sätze 22-24/25 siehe oben siehe oben LD50 190 mg·kg−1 (Ratte, intraperitoneal) [1] Tropolone sind die Hydroxyderivate des Tropons.[2] Besonders bekannt ist α-Tropolon, außerdem kennt man noch β- und γ-Tropolon. Die Tropolone bestehen aus einem siebengliedrigen carbocyclischen Ringsystem mit drei konjugierten Doppelbindungen, einer Carbonyl- und einer Hydroxygruppe. Die Tropolone sind 6π-Aromaten. Im α-Tropolon befinden sich Carbonyl- und Hydroxygruppe in 1,2-Stellung am Ring. Dem β-Tropolon (1,3-Substitution) und dem γ-Tropolon (1,4-Substitution) kommt keine besondere Bedeutung zu.
Inhaltsverzeichnis
Vorkommen in der Natur
Der α-Tropolon-Ring findet sich in einer Reihe von Naturstoffen, z. B. in Hinokitiol und der Stipitatsäure, die aus dem Schimmelpilz Penicillium stipitatum isoliert wurde sowie im Kernholz der roten Zeder (Thuja plicata). Purpurogallin enthält ebenfalls das Strukturmotiv des α-Tropolons. Colchicin ist das Hauptalkaloid von Colchicum autumnale (Herbstzeitlose) und kann als komplexes α-Tropolon-Derivat betrachtet werden.
Synthese
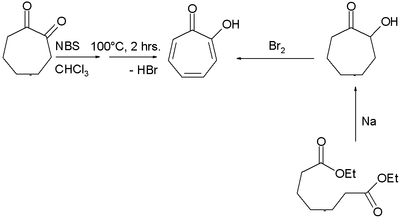
Die Oxidation von Cycloheptanon mit Selendioxid führt zu 1,2-Cycloheptandion. Die anschließende Bromierung-Dehydrobromierung im basischen Medium und eine Hydrierung führt zu α-Tropolon.[3]
Eigenschaften
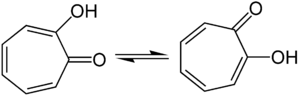
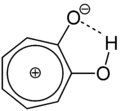
Das α-Tropolon kommt in zwei tautomeren Formen vor, was durch Infrarotsprektren belegt wurde. Da die tautomere Umwandlungsgeschwindigkeit sehr groß ist, wird ebenfalls eine Strukturformel mit einer Wasserstoffbrückenbindung postuliert. Der Wechsel des Protons von einem Sauerstoffatom zum anderen führt zugleich zu einer Verschiebung der π-Elektronen der Doppelbindungen, die in einem eben gebauten Siebenring mit 6π-Elektronen zur Ausbildung eines mesomeriestabilisierten Systems führt, der die Hückel-Regel erfüllt, also ein Aromat ist:
Reaktivität
α-Tropolon lässt sich – wie viele andere Aromaten – nitrieren und bromieren. Es kuppelt mit Diazoniumsalzen. Durch Erhitzen wird es zu Benzoesäure isomerisiert.
Einzelnachweise
- ↑ a b c d e f Datenblatt Tropolone bei Sigma-Aldrich, abgerufen am 24. April 2010.
- ↑ G. Huber: "Das Tropolon und seine Derivate", in: Angewandte Chemie, 1951, 63, S. 501–508; doi:10.1002/ange.19510632102.
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 619–620.
Weblinks
Wikimedia Foundation.